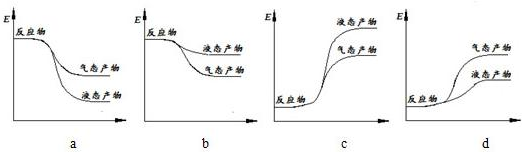
题目内容
14.根据下列物质的化学性质,判断其应用错误的是( )| A. | 酒精能使蛋白质变性,可用于杀菌消毒 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 明矾溶于水产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | 合金的性质与其组成金属的性质不完全相同,合金用途更广泛 |
分析 A.酒精能使蛋白质变性而杀菌消毒;
B.氧化钙和二氧化硫、氧气发生化学反应生成硫酸钙;
C.氢氧化铝胶体能吸附水中的悬浮物而净水;
D.合金硬度大,熔点低.
解答 解:A.在75%的酒精作用下,乙醇能渗入细胞内,使蛋白质凝固变性,从而起到杀菌的作用,故A正确;
B.高温条件下,氧化钙和二氧化硫、氧气反应能生成硫酸钙,反应的化学方程式为:2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,所以CaO能用于燃煤的脱硫,故B正确;
C.明矾中铝离子水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而净水,故C错误;
D.合金的性质与组分金属的化学性质相同,但物理性质不同,硬度大,熔点低,用途广泛,故D正确.
故选C.
点评 本题涉及环境保护、净水等知识点,明确物质的性质是解本题关键,注意水的净化和水中杀菌消毒的原理区别,题目难度不大.

练习册系列答案
相关题目
5.资料显示:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
9.下列单质或化合物性质的描述正确的是( )
| A. | 加入铝粉能产生H2的溶液中,一定存在大量的Na+,Ba 2+,AlO2-,NO3- | |
| B. | SiO2与酸,碱均不反应 | |
| C. | NO2溶于水时发生氧化还原反应 | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
19.乙烯在含有少量SO2、CO2及水蒸气,用下列5中试剂检验这四种气体,混合物通过试剂的顺序依次是( )
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液.
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液.
| A. | ④⑤①②③ | B. | ④⑤①③② | C. | ⑤①③②④ | D. | ④③①⑤② |
6.某化学实验兴趣小组在“探究氯水与溴化亚铁溶液反应”的实验中发现:“在足量的溴化亚铁溶液中,加入1~2滴氯水,振荡后溶液呈黄色.”
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
猜想Ⅰ:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-( 填离子方程式)所致.
猜想Ⅱ:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-( 填离子方程式)所致.
(2)设计实验并验证:
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
所给试剂:酚酞试液、CCl4、无水酒精、KSCN溶液
方案1:取所述黄色溶液于试管中,滴加KSCN并振荡,溶液变红色;则溶液变黄色由反应①所致.
方案2:取所述黄色溶液于试管中,滴加CCl4并振荡;实验现象为CCl4层(下层)无色.
(3)实验结论:
以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-
强(填“强”或“弱”).
(4)实验反思:
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上下层均为黄色.
Ⅱ.在100mLFeBr2溶液中通入2.24LCl2(标准状况下),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
| 『资料』 | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色. |
(1)提出问题猜想:
猜想Ⅰ:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-( 填离子方程式)所致.
猜想Ⅱ:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-( 填离子方程式)所致.
(2)设计实验并验证:
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
所给试剂:酚酞试液、CCl4、无水酒精、KSCN溶液
方案1:取所述黄色溶液于试管中,滴加KSCN并振荡,溶液变红色;则溶液变黄色由反应①所致.
方案2:取所述黄色溶液于试管中,滴加CCl4并振荡;实验现象为CCl4层(下层)无色.
(3)实验结论:
以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-
强(填“强”或“弱”).
(4)实验反思:
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上下层均为黄色.
Ⅱ.在100mLFeBr2溶液中通入2.24LCl2(标准状况下),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
3.在实验室进行下列实验,不使用水浴加热的是( )
| A. | 苯的硝化反应 | B. | 乙酸乙酯水解 | C. | 乙醛与Cu(OH)2反应 | D. | 醛的银镜反应 |
4.下列物质中属于电解质的是( )
| A. | 氯化钠晶体 | B. | 酒精 | C. | 氨气 | D. | 盐酸 |

 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.