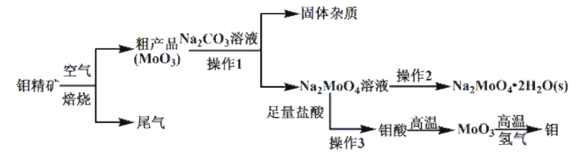
题目内容
【题目】锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
(1)该电池的正极材料是________;电池工作时,阳离子向________(填“正极”或“负极”)移动;负极的反应式为__________。
(2)①电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,化学反应方程式为ZnO+C![]() Zn+CO↑,此法为_____。
Zn+CO↑,此法为_____。
A 电解法 B 热还原法 C 热分解法
(3)可用石墨作电极电解提纯氢氧化钾电解液。电解池内的阳离子交换膜只允许阳离子通过,其工作原理如图所示。
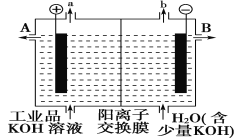
①该电解池的阳极,阴极反应式为阳极:_________阴极:________
②除去杂质后的氢氧化钾溶液从出口________(填“A”或“B”)导出。
③在相同条件下,a处与b处产生的气体体积比为________。
【答案】Ag2O 正极 Zn-2e-+2OH-=ZnO+H2O B 4OH--4e-= O2↑+2H2O 2H++2e-=H2↑ B 1∶2
【解析】
(1)正极发生还原反应,故Ag2O为正极,原电池工作时电解质溶液中阳离子向正极移动;负极发生氧化反应,Zn失电子碱性条件下生成ZnO与水,电极反应式:Zn-2e-+2OH-═ZnO+H2O;
(2)高温下发生置换反应,属于热还原法,故答案为B;
(3)①阳极发生氧化反应,溶液中氢氧根离子放电得到氧气,电极反应式为:4OH--4e-= O2↑+2H2O,阴极发生还原反应,溶液中氢离子放电得到氢气,电极反应式为:2H++2e-═H2↑;
②在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液,除杂后的氢氧化钾溶液从出口B导出;
③电解时,a为阳极,电极反应式:4OH--4e-=2H2O+O2↑,b为阴极,电极反应式:4H++4e-=2H2↑,转移相同电子数时,a处与b处产生的气体体积比为1:2。