题目内容
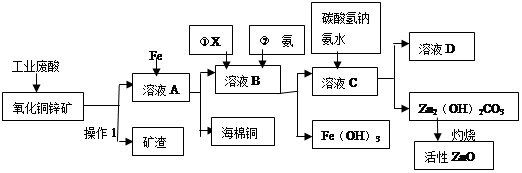
银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品CuAlO2的工艺如下:(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)

(1)铜的核外电子排布式为 .
(2)电解精炼银时,阴极反应式为 滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 .
(3)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,最后将得不到CuAlO2 ,写出因NaOH过量引起的反应的离子方程式 .
(4)若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),则滤液中的阳离子有 .
(5)完成上述煅烧过程中一个反应的化学方程式:
CuO + Al2O3 Cu AlO2 + (系数1也要写).
Cu AlO2 + (系数1也要写).
(6)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L .

(1)铜的核外电子排布式为 .
(2)电解精炼银时,阴极反应式为 滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 .
(3)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,最后将得不到CuAlO2 ,写出因NaOH过量引起的反应的离子方程式 .
(4)若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),则滤液中的阳离子有 .
(5)完成上述煅烧过程中一个反应的化学方程式:
CuO + Al2O3
 Cu AlO2 + (系数1也要写).
Cu AlO2 + (系数1也要写).(6)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L .
(1)1s2s22p63s23p63d104s1或[Ar]3d104s1 (2)Ag++e-=Ag 2NO+O2=2NO2
(3)Al(OH)3和CuO Al(OH)3+OH-=AlO2—+2H2O(4)[Cu(NH3)4]2+、NH4+、、H+、Na+。(5)4 2 =4 1 O2↑ (6)25.0
(3)Al(OH)3和CuO Al(OH)3+OH-=AlO2—+2H2O(4)[Cu(NH3)4]2+、NH4+、、H+、Na+。(5)4 2 =4 1 O2↑ (6)25.0
试题分析:(1)Cu是29号元素,其核外电子排布式为1s2s22p63s23p63d104s1或[Ar]3d104s1(2)电解精炼金属时,粗金属作阳极,精金属作阴极。阳极反应氧化反应,阴极发生还原反应。所以电解精炼银时,阴极精银上的反应式为Ag++e-=Ag。滤渣A与稀HNO3反应,产生的无色气体是NO,它遇空气迅速变为红棕色的NO2,该气体变色的化学方程式为2NO+O2=2NO2。(3)发生的反应为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4; Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4; 100度煮沸时氢氧化铜发生分解反应:Cu(OH)2
 CuO+H2O. Al(OH)3不分解。所以得到的固体混合物B是Al(OH)3和CuO。氢氧化铝能被过量的强碱溶解产生容易溶解于水的偏铝酸盐。NaOH过量引起的反应的离子方程式Al(OH)3+OH-=AlO2—+2H2O。 (4)氢氧化铝只能被强碱溶解而不能溶解在氨水中。若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),Cu2+与NH3结合形成[Cu(NH3)4]2+,就不再产生氢氧化铜沉淀,铝以氢氧化铝的形式存在固体沉淀中。则滤液中含有的阳离子有[Cu(NH3)4]2+、NH4+、、H+、Na+。(5)根据质量守恒定律及电子守恒可知个物质的系数及缺少的物质的化学式是:4 2 == 4 1 O2↑。(6)m(Cu)= 64%×5.0kg=3.2Kg=3200g.n(Cu)=m÷M=3200g÷64g/mol=50mol.。由于在CuAlO2中Cu、Al个数比为1:1.所以根据原子守恒可得:n[Al2(SO4)3]="1/2n(Al)=" 1/2 n(Cu)="25mol." n=C·V.故V=n/C=25mol÷1mol/L=25L.
CuO+H2O. Al(OH)3不分解。所以得到的固体混合物B是Al(OH)3和CuO。氢氧化铝能被过量的强碱溶解产生容易溶解于水的偏铝酸盐。NaOH过量引起的反应的离子方程式Al(OH)3+OH-=AlO2—+2H2O。 (4)氢氧化铝只能被强碱溶解而不能溶解在氨水中。若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),Cu2+与NH3结合形成[Cu(NH3)4]2+,就不再产生氢氧化铜沉淀,铝以氢氧化铝的形式存在固体沉淀中。则滤液中含有的阳离子有[Cu(NH3)4]2+、NH4+、、H+、Na+。(5)根据质量守恒定律及电子守恒可知个物质的系数及缺少的物质的化学式是:4 2 == 4 1 O2↑。(6)m(Cu)= 64%×5.0kg=3.2Kg=3200g.n(Cu)=m÷M=3200g÷64g/mol=50mol.。由于在CuAlO2中Cu、Al个数比为1:1.所以根据原子守恒可得:n[Al2(SO4)3]="1/2n(Al)=" 1/2 n(Cu)="25mol." n=C·V.故V=n/C=25mol÷1mol/L=25L.
练习册系列答案
相关题目
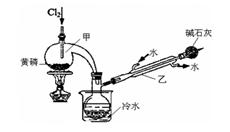
 2PCl3;2P+5Cl2
2PCl3;2P+5Cl2