题目内容
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下。已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。

(1)硼氢化钠(NaBH4)的电子式为 ;其中B元素的化合价为
(2)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是:________________。
(3)请配平第①步反应的化学方程式: NaBO2+ SiO2+ Na+ H2----- NaBH4+ Na2SiO3
(4)第②步操作需要的玻璃仪器有: ;第③步分离(NaBH4)并回收溶剂,采用的方法是____。
【答案】(1)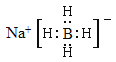 +3
+3
(2)排尽装置内空气及水汽
(3) 1 NaBO2+ 2 SiO2+ 4 Na+ 2 H2= 1 NaBH4+ 2 Na2SiO3
(4)烧杯、玻璃棒、漏斗;蒸馏
【解析】
试题分析:(1)硼氢化钠中Na是+1价,H是-1价,因此B元素的化合价是+3价,该化合物是离子化合物,电子式为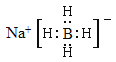 ;
;
(2)由于NaBH4常温下能与水反应,且Na比较活泼,加热到100℃以上,充入氩气,是除去反
应器中的水蒸气和空气,避免影响反应;
(3)反应中H元素化合价从0价降低到-1价,Na元素化合价从0价升高到+1价,则根据氧化还原反应原理,得失电子总相同,可以配平此反应为:NaBO2+2SiO2+4Na+2H2==NaBH4+2Na2SiO3;
(4)从流程图中可以看出第②步分离的是固体和液体混合物,所以选用过滤的方法,需要的玻璃仪器有烧杯、玻璃棒、漏斗;第③步分离(NaBH4)并回收溶剂,只能先将溶剂蒸发再冷凝回收,即蒸馏的方法分离。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目


