题目内容
【题目】亚硝酸钠是重要食品添加剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)查阅资料:①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
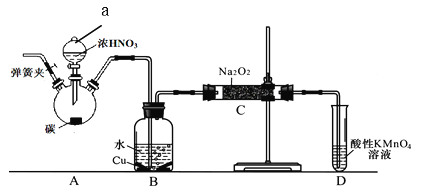
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为 ,A中反应的化学方程式是 ;
(2)D装置的作用是 ;
(3)C中反应生成NaNO2的化学方程式是 ;
(4)检验C中产物有亚硝酸钠的正确操作是 (填序号) ;
a.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2
b.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2
(5)经检验C的产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称);
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 ;
【答案】(1)分液漏斗;C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)除去未反应的NO,防止污染空气(3)2NO+Na2O2=2NaNO2
(4)a(5)①碱石灰②打开弹簧夹,通入N2一段时间
【解析】试题分析:(1)a名称是分液漏斗;C和HNO3(浓)发生反应生成CO2、NO2、H2O,反应方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)NO有毒不能直接排空,NO和酸性高锰酸钾溶液反应生成硝酸根离子和锰离子,从而除去NO;
(3)NO和Na2O2发生反应生成NaNO2,反应方程式为 2NO+Na2O2=2NaNO2;
(3)a.亚硝酸钠能和稀硫酸反应生成无色气体NO,NO不稳定易被氧气氧化生成红棕色气体二氧化氮,该实验现象说明含有亚硝酸钠,故a正确;b.A中生成二氧化碳,二氧化碳和过氧化钠反应生成碳酸钠,碳酸钠溶液也呈碱性,B中出来的气体中还含有水蒸气能和C中的过氧化钠反应生成NaOH而呈碱性,所以不能根据其水溶液判断含有亚硝酸钠,故b错误;故选a;
(4)①从B装置中出来的气体中含有NO、二氧化碳和水蒸气,这几种物质都能和过氧化钠反应,要使C中只有NO和过氧化钠反应,则BC装置间的E装置应该能吸收水蒸气和二氧化碳,使用的药品是碱石灰;
②要排除空气防止发生反应,应该先通入一段时间的氮气。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】下图是元素周期表的一部分
A | |||||||||||||||||
B | C | D | E | F | |||||||||||||
H | I | J | K | [Z | |||||||||||||
L | M | O |
(1)元素L的价电子排布图为 ,元素M的原子结构示意图为 ,位于元素周期表五个区域中的 区。上述元素中电负性最强的是 (用元素符号表示),C、D、E、F第一电离能的大小顺序为 (用元素符号表示)。
(2)D的氢化物和J氢化物沸点较高的是 (填化学式),稳定性更强的是 (填化学式)。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素I与元素B的氢氧化物有相似的性质。写出元素B的氢氧化物与NaOH溶液反应的离子方程式 。
(4)A、E、H、J四种元素的原子半径由大到小的排列顺序为 (用元素符号表示);E、F、H、K四种元素简单离子的半径由大到小的排列顺序为 (用元素符号表示)。
(5)能证明元素K比元素J的非金属性强的事实是 (填序号)。
A.常温下K单质的密度小于J单质的密度
B.K元素的气态氢化物比J元素的气态氢化物更稳定
C.K单质与氢气反应的程度比J单质与氢气反应的程度更剧烈
D.K元素的氧化物对应的水化物酸性强于J元素的氧化物对应的水化物