题目内容
【题目】某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br﹣、SO ![]() 、Cl﹣等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程.
、Cl﹣等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程. 
研究性学习小组查寻资料得知:Br﹣被氧化剂氧化成溴.溴不易溶于水而易溶于CCl4回答以下问题:
(1)操作Ⅰ的名称为;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还有 .
(2)试剂x,y,z的化学式分别为x , y , z;检验SO ![]() 已除尽的方法是 .
已除尽的方法是 .
(3)写出操作Ⅲ的具体操作步骤 .
【答案】
(1)萃取、分液;蒸馏烧瓶、冷凝管、牛角管、锥形瓶
(2)BaCl2;KOH;K2CO3;取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42﹣已除尽
(3)将溶液倒入蒸发皿中并置于三脚架上,加热并用玻璃棒不断搅拌蒸发皿中的液体,直到溶液表面出现晶膜时,停止加热
【解析】解:(1)操作Ⅰ为互不相溶的液体混合物,应为萃取、分液;由于溴和CCl4的沸点不同,可用蒸馏的方法分离,蒸馏时用到的仪器有酒精灯、温度计、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等,所以答案是:萃取、分液;蒸馏烧瓶、冷凝管、牛角管、锥形瓶;(2)除去溶液中的Mg2+、SO42﹣ , 应分别加入过量的BaCl2、KOH、K2CO3 , 类似于粗盐的提纯,加入过量BaCl2可除去SO42﹣ , 加入过量KOH溶液可除去Mg2+ , 最后加入K2CO3可除去BaCl2 , 检验SO42﹣已除尽的方法是取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42﹣已除尽,所以答案是:BaCl2、KOH、K2CO3 , 取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42﹣已除尽;(3)操作Ⅲ为蒸发操作,蒸发时将溶液倒入蒸发皿中并置于三脚架上;加热并用玻璃棒不断搅拌蒸发皿中的液体,直到出现较多晶体时,停止加热,注意不能直接蒸干,所以答案是:将溶液倒入蒸发皿中并置于三脚架上,加热并用玻璃棒不断搅拌蒸发皿中的液体,直到溶液表面出现晶膜时,停止加热.

【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
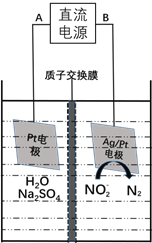
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。