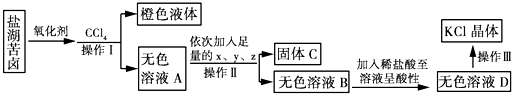
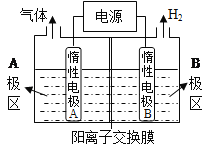
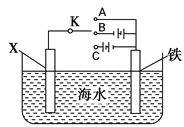
题目内容
【题目】氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①CH3OH(l)+O2(g )= CO(g)+2H2O(g) △H= - 354.8 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
③H2O(g) = H2O(l) △H= -44.0 kJ·mol-1
请写出甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:______________________________。
(2)某实验小组利用H2(g)、O2(g)、KOH(aq)设计成电池装置(装置Ⅰ),通过装置Ⅱ实现铁棒上镀铜。
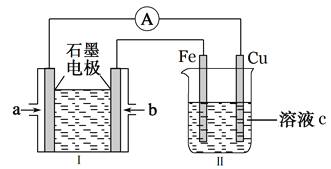
①装置Ⅰ中,a口通入的气体为____________(填“H2”或“O2”),放电时,溶液中的K+向______极移动(填“正”或“负”),该电池负极的电极反应式为______________________。
②装置Ⅱ中,溶液c可选用________________溶液。
若电镀结束后,装置Ⅱ中Fe电极的质量改变了12.8g,则装置Ⅰ中理论上消耗氧气的体积为________L(标准状况下)
【答案】 2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l) △H=-1451.6 kJ·mol-1 O2 正 H2-2e-+2OH-===2H2O CuSO4 2.24
【解析】(1)①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJmol-1,②2CO(g)+O2(g)═2CO2(g) △H=-566.0kJmol-1,③H2O(g)═H2O(l)△H=-44.0kJmol-1,根据盖斯定律,将①×2+②+③×4得到2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l),所以该反应的△H=(-354.8kJ/mol)×2 +(-566.0kJ/mol) +(-44.0kJ/mol)×4=- 1451.6kJmol-1,即2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l) △H=-1451.6kJmol-1,故答案为:2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l)△H=-1451.6kJmol-1;
(2)①根据图示,装置I为氢氧燃料电池,装置II为电解池,通过装置Ⅱ实现铁棒上镀铜,则铁作阴极,即b为负极,则b极上通入氢气,a口通入氧气;放电时,溶液中的K+向正极移动,负极的电极反应式为H2-2e-+2OH-=2H2O,故答案为:O2;正;H2-2e-+2OH-===2H2O;
②装置Ⅱ为电镀池,实现铁棒上镀铜,溶液c可选用硫酸铜溶液,电镀结束后,Fe电极的质量改变了12.8g,为析出的铜,物质的量为![]() =0.2mol,转移0.4mol电子,则装置Ⅰ中理论上消耗氧气0.1mol,标准状况下的体积为2.24L,故答案为:CuSO4;2.24。
=0.2mol,转移0.4mol电子,则装置Ⅰ中理论上消耗氧气0.1mol,标准状况下的体积为2.24L,故答案为:CuSO4;2.24。