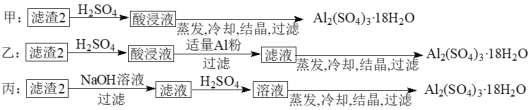
题目内容
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
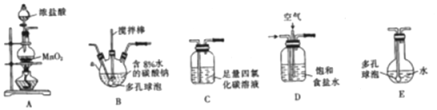
(1)各装置的连接顺序为______→ → →C→ 。
(2)装置B中多孔球泡和搅拌棒的作用是____________________________________ ;装置C的作用是_____________________。
(3)制备Cl2O的化学方程式为________________________。
(4)反应过程中,装置B需放在冷水中,其目的是_____________________________。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_______。
【答案】A→D→B→C→E 增大反应物接触面积,使反应充分进行,加快反应速率 除去Cl2O中的Cl2。 2Cl2+Na2CO3=Cl2O+2NaCl+CO2(或者2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3) 防止反应放热后温度过高导致Cl2O分解 制得的次氯酸溶液纯度较高,浓度较大
【解析】
(1)根据实验目的,要将Cl2和空气混合通入含Na2CO3溶液中制备Cl2O,应先用装置A制备Cl2,再通过装置D除去混合气体中的HCl气体,同时混入空气,将混合气体通入装置B,在装置B中发生制备Cl2O的反应;然后将制取的Cl2O气体先通入装置C,以除去Cl2杂质气体,最后通过装置E制取次氯酸溶液,故装置的连接顺序为A→D→B→C→E。答案:A→D→B→C→E。
(2)多孔球泡和搅拌棒均能增大反应物的接触面积,加快反应速率,使反应充分快速进行。装置C的作用是除去Cl2O中的Cl2。答案:增大反应物接触面积,使反应充分进行,加快反应速率 、除去Cl2O中的Cl2。
(3)已知空气不参与反应,则制取Cl2O以Cl2和Na2CO3为反应物,发生歧化反应,其中氯元素从0价变为+1价和-1价,反应的化学方程式为:2Cl2+Na2CO3=Cl2O+2NaCl+CO2或2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3。
(5)已知Cl2O在42 ℃以上会分解生成Cl2和O2,因此反应过程中,装置B需放在冷水中,防止反应放热后温度过高导致Cl2O分解。答案:防止反应放热后温度过高导致Cl2O分解。
(6)Cl2O与水反应的化学方程式为:Cl2O+H2O= 2HClO ,Cl2和水反应的化学方程式为Cl2+H2O![]() HClO+HCl,Cl2O和水反应只生成HClO 且反应不可逆,Cl2和水反应除了生成HClO还生成HCl,并且反应可逆,所以用Cl2O与水反应制备次氯酸溶液的主要优点是用Cl2O与水反应制备次氯酸溶液时制得次氯酸溶液纯度较高、浓度也较大。答案:制得的次氯酸溶液纯度较高,浓度较大。
HClO+HCl,Cl2O和水反应只生成HClO 且反应不可逆,Cl2和水反应除了生成HClO还生成HCl,并且反应可逆,所以用Cl2O与水反应制备次氯酸溶液的主要优点是用Cl2O与水反应制备次氯酸溶液时制得次氯酸溶液纯度较高、浓度也较大。答案:制得的次氯酸溶液纯度较高,浓度较大。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作、实验现象和实验结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将Al2(SO4)3溶液和NaHCO3溶液混合 | 产生白色沉淀,并有大量气体生成 | 生成Al2(CO3)3沉淀和CO2气体 |
B | 在淀粉溶液中加入几滴稀硫酸,水浴5min,加入NaOH溶液调溶液pH至碱性,再加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 淀粉完全水解 |
C | 将少量SO2气体通过足量Na2O2 | 余下气体能使带火星木条复燃 | 有O2生成 |
D | 用pH试纸分别测定等浓度的A、B两溶液(可能为NaHCO3或者Na2CO3)的pH值 | pHA> pHB | A溶液为Na2CO3溶液 |
A. A B. B C. C D. D