题目内容
【题目】下列电离方程式错误的是( )
A. Na2CO3![]() 2Na++CO32- B. Ba(OH)2
2Na++CO32- B. Ba(OH)2![]() Ba2++2OH—
Ba2++2OH—
C. H2SO4![]() 2H++SO42- D. KClO3
2H++SO42- D. KClO3![]() K++Cl-+3O2-
K++Cl-+3O2-
【答案】D
【解析】强电解质在溶液中能完全电离,弱电解质部分电离,多元弱酸分步电离,离子团在电离方程式中不能拆开,据此分析判断。
A.碳酸钠属于盐,是强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,故A正确;B.氢氧化钡为强碱,是强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,故B正确;C.硫酸为强酸,是强电解质,完全电离,电离方程式为:H2SO4=2H++SO42-,故C正确;D.KClO3属于盐,是强电解质,完全电离,电离方程式为:KClO3=K++ ClO3-,故D错误;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
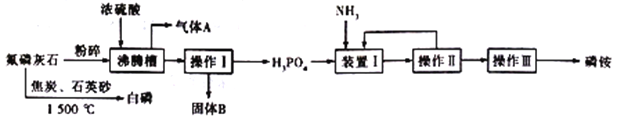
小学生10分钟应用题系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_____________。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是________________。(填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________。(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_______。(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
【题目】下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的元素是__________。
(2)最高价氧化物的水化物碱性最强的元素是__________。
(3)可用于制半导体材料的元素是_______。
(4)表中元素,只有负价没有正价的元素是_________。