��Ŀ����
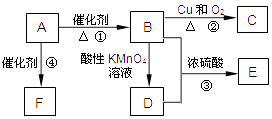
����Ŀ��Ϊ��ȥ�����е�CaCl2��MgCl2��Na2SO4 �Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£�![]()
��1���ж�BaCl2�ѹ����ķ�������
��2���ڢ��У���ص����ӷ���ʽ����
��3��Ϊ���龫�δ��ȣ�������230mL0.2mol/L NaCl(����)��Һ��������������ƽ��ȡ���ι��������Ϊ �� ��Ҫ�IJ�����������Ͳ�� ��
��4������NaCl(����)��Һʱ�����������в�������ɽ��ƫ�͵�����
A������ʱNaCl�ѳ��� B����ƽ����������ʴ
C������ҡ��ʱ��Һ���½��ּ�ˮ D������ʱ���ӿ̶���
���𰸡�
��1�����ϲ���Һ�м����μ�BaCl2��Һ,�����dz���,��֤��BaCl2����
��2��H++OH-=H2O��2H++CO32-=CO2+H2O
��3��2.9g,�ձ���250ml����ƿ����ͷ�ιܡ�������
��4��A C D
�������� (1)�������Ȼ����Ὣȫ������������ӳ�����ȫ��ֻҪ�������ʣ�࣬���Ȼ��������䷴Ӧ���ְ�ɫ�����������ж�BaCl2�ѹ����ķ����ǣ�ȡ�ڢڲ�����ϲ���Һ(��ȡ�����ϲ���Һ���Թ���)���ٵ�������BaCl2��Һ������Һδ����ǣ������BaCl2�ѹ��������Դ��ǣ����ϲ���Һ�еμ�BaCl2��Һ�������dz��֣���֤��BaCl2�ѹ�����(2)�ڢ��м������������Ŀ���dz�ȥ�������������ƺ�̼���ƣ���ص����ӷ���ʽ��H++OH-=H2O��2H++CO32-=CO2+H2O��
(3)����230mL0.2mol/L NaCl(����)��Һ��Ӧ��ѡ��250mL������ƿ�������ƣ����辫�ι��������Ϊ0.25L��0.2mol/L��58.5g/mol=2.9g������һ�����ʵ���Ũ�ȵ���Һ�����У����㡢�������ܽ⡢��ȴת�ơ�ϴ��ת�ơ����ݡ�ҡ�ȡ�ʹ�õ��IJ��������У���Ͳ���ձ�����������250mL����ƿ����ͷ�ιܣ����Դ��ǣ��ձ���250ml����ƿ����ͷ�ιܡ���������(4)A������ʱNaCl�ѳ��⣬�Ƶõ��������Ƶ�����ƫС����������ҺŨ��ƫ�ͣ���A��ȷ��B����ƽ�ǽϾ��ܵIJ������ߣ�����������ʱ������������������ֵ�Ƶõ��������Ƶ�����ƫ����������ҺŨ��ƫ�ߣ���B����C������ҡ��ʱ��Һ���½��ּ�ˮ������������Һ���Vƫ��������ҺŨ��ƫ�ͣ���C��ȷ��D������ʱ���Ӷ�ȡ�̶ȣ�����������Һ���Vƫ��������ҺŨ��ƫ�ͣ���D��ȷ����ѡACD��
�����㾫����������Ŀ����֪���������ù��ˡ�������ע����Һ�������ͻ�ѧʵ��������Ⱥ�˳������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���չ���Һ��ʱ��©�����Һ���Һ�治Ҫ������ֽ�ı�Ե���������ʽ�����Һ����ѧʵ��˳����ѭ�����������ϡ�ԭ�������ҡ�ԭ���ȡ���������ԭ�������ȷš�ԭ��Һ���ӡ�ԭ�����������ԣ�װ��ҩƷǰ���У�ԭ���ƾ��ƣ�����װ����Ϻ��ٵ�ƾ��ƣ�ԭ��

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�����Ŀ���������ȣ�ClNO�����л��ϳ��е���Ҫ�Լ����������ȿ���NO��Cl2��ͨ�������·�Ӧ�õ�����ѧ����ʽΪ2NO��g��+Cl2��g��2ClNO��g����
��1�����������������ڴ����еĺ������������ʱ�������������ȣ��漰���·�Ӧ��
��4NO2��g��+2NaCl��s��2NaNO3��s��+2NO��g��+Cl2��g�� K1
��2NO2��g��+NaCl��s��NaNO3��s��+ClNO��g�� K2
��2NO��g��+Cl2��g��2ClNO��g�� K3
��K1 �� K2 �� K3֮��Ĺ�ϵΪK3= ��
��2��T��ʱ��2NO��g��+Cl2��g��2ClNO��g��������Ӧ���ʱ���ʽΪv��=k cn��ClNO����������ʺ�Ũ�ȵĹ�ϵ�����
��� | c��ClNO��/molL��1 | v/molL��1s��1 |
�� | 0.30 | 3.6��10��8 |
�� | 0.60 | 1.44��10��7 |
�� | 0.90 | 3.24��10��7 |
n=��k=��ע����λ����
��3����2L�ĺ����ܱ������г���4molNO��g����2molCl2��g�����ڲ�ͬ�¶��²��c��ClNO����ʱ��Ĺ�ϵ��ͼA�� 
���¶�ΪT1ʱ������Ϊ�÷�Ӧ�ﵽƽ��ı�־������
a������������ֲ��� b������ѹǿ���ֲ��� c��ƽ�ⳣ��K���ֲ���
d��������ɫ���ֲ��� e��v��ClNO��=v��NO�� f��NO�� ClNO�����ʵ�����ֵ���ֲ���
�ڷ�Ӧ��ʼ��10minʱCl2��ƽ����Ӧ����v��Cl2��=��
���¶�ΪT2ʱ��10min�Ѿ��ﵽƽ�⣬�÷�Ӧ��ƽ�ⳣ��K=��ע����λ����
��4��һ���������ں��º��ݵ��ܱ������а�һ����������NO��g����Cl2��g����ƽ��ʱClNO������������� ![]() �ı仯ͼ����ͼB����A��B��C��״̬�У�NO��ת������С�����㣬��n��NO��/n��Cl2��=2.8ʱ���ﵽƽ��״̬ClNO����������տ�����D��E��F�����е��㣮
�ı仯ͼ����ͼB����A��B��C��״̬�У�NO��ת������С�����㣬��n��NO��/n��Cl2��=2.8ʱ���ﵽƽ��״̬ClNO����������տ�����D��E��F�����е��㣮