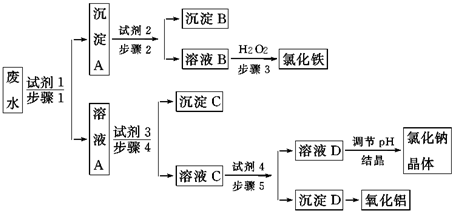
题目内容
16. 利用水煤气合成甲醇是煤液化的一种重要方法,其反应的热化学方程式为CO(g)+2H2(g)?CH3OH(l)△H=-90.8kJ•mol-1,在容积为1L的恒容密闭容器中,充入一定量CO和H2,测得CO和H2的物质的量的变化曲线如图所示.
利用水煤气合成甲醇是煤液化的一种重要方法,其反应的热化学方程式为CO(g)+2H2(g)?CH3OH(l)△H=-90.8kJ•mol-1,在容积为1L的恒容密闭容器中,充入一定量CO和H2,测得CO和H2的物质的量的变化曲线如图所示.(1)下列能说明反应达到平衡状态的标志是CD
A.生成1molO一H键的同时断裂2molH-H键
B.2v(CO)=v(H2)
C.CO的含量不再发生变化
D.混合气体的密度不再发生变化
(2)图中a线代表的物质是H2.前4s内用CO表示的平均反应速率是0.5mol/(L•s)
(3)某同学研究在230℃、250℃和270℃三种温度下合成甲醇的规律,测得在CO的平衡转化率如图.
①图中曲线Z对应的温度是270℃.
②增大H2和CO的起始组成比,反应放出的热量将(填“增多”“减少”或“不变”)
③270℃下,上述反应的化学平衡常数K1=4.其他条件均相同,若在容积为2L的容器中进行上述反应,则此时的化学平衡常数K2=(填“>”“<“或“=”)K1.
分析 (1)达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量都不再发生变化,据此进行判断;
(2)根据曲线a、b的物质的量变化判断a曲线代表的物质;
(3)①根据温度对该反应的影响判断Z对应的温度;
②增大氢气和一氧化碳的比例,则平衡向着正向移动;
③利用三段式列式计算出平衡常数;容积不影响化学平衡常数.
解答 解:(1)A.生成1molO一H键的同时断裂2molH-H键,表示的都是正反应速率,无法判断正逆反应速率是否相等,故A错误;
B.2v(CO)=v(H2),没有指出正逆反应速率,则无法判断是否达到平衡状态,故B错误;
C.CO的含量不再发生变化,说明正逆反应速率相等,达到了平衡状态,故C正确;
D.该反应是气体质量发生变化的反应,容器的容积不变,则混合气体的密度不再发生变化,说明各组分的浓度不再变化,已经达到平衡状态,故D正确;
故答案为:CD;
(2)根据曲线变化可知,a曲线达到平衡时物质的量变化为:6mol-2mol=4mol,b曲线的物质的量变化为:3mol-1mol=2mol,根据反应CO(g)+2H2(g)?CH3OH(l)可知a曲线表示的是H2,则b曲线表示的是CO,4s内用CO表示的平均反应速率为:v(CO)=$\frac{\frac{2mol}{1L}}{4s}$=0.5mol/(L•s),
故答案为:H2;0.5mol/(L•s);
(3)①由于该反应为放热反应,温度越高CO的转化率越小,所以曲线Z为270℃,
故答案为:270℃;
②增大H2和CO的起始组成比时,平衡正向移动,放出热量增多,
故答案为:增大;
③由图象可知当270℃时,CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×0.{5}^{2}}$=4;
其他条件均相同,若在容积为2L的容器中进行上述反应,由于温度不变,则该反应的平衡常数不变,即:K2=K1,
故答案为:4;=.
点评 本题考查了化学平衡常数的计算、化学平衡状态的判断,题目难度中等,明确化学平衡的影响因素为解答关键,注意掌握化学平衡常数、化学反应速率的计算方法,试题培养了学生的分析能力及化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 铅蓄电池放电时负极质量减少 | |
| B. | 在海轮外壳连接镁合金保护外壳不受腐蚀 | |
| C. | 对于同一个化学反应,一步完成和分步完成其反应的焓变亦不相同 | |
| D. | 反应 MnO4-+H2O2+H+═Mn2++H2O+O2(未配平)中每生成1 mol O2转移2 mol e- |
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm. |
| Y | 所在主族序数与所在周期序数之差为4. |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰. |
| D | 最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子. |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏. |
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法不正确的是②③(填序号).
①保存EY2溶液时,需向溶液加入少量E单质.
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可.
③EY2只能通过置换反应生成,EY3只能通过化合反应生成.
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒.
(3)用化学符号表示D2Z的水溶液中各离子浓度从大到小的顺序是Na+>S2->OH->HS->H+.
| A. | 少量Mg(OH)2固体可溶于较浓的NH4Cl溶液中:Mg(0H)2+2NH4+=Mg2++2NH3•H2O | |
| B. | 在CuSO4溶液中加入pbs,可转变为铜蓝(CuS):Cu2++Pbs=Pb2++CuS | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(0H)2溶液至SO42-沉淀完全:2A13++3SO42-+3Ba2++60H-=3BaS04↓+2A1(0H)3↓. |
| A. | 铁晶须是合金 | B. | 铁晶须不与酸反应 | ||
| C. | 铁晶须可被磁铁吸引 | D. | 铁晶须易溶于水 |
| A. | 在鸡蛋清溶液中加入稀的或饱和的NaCl溶液,其作用是-样的 | |
| B. | 尼龙、棉花、天然橡胶、ABS树脂都是由高分子化合物组成的物质 | |
| C. | 在一定条件下,苯与浓溴水、浓硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| D. | 开发核能、太阳能等新能源.推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排. |
| A. | pH等于7的氨水与硫酸铵的混合溶液中c(NH4+)与c(SO42-)之比 | |
| B. | 相同温度下,1L 0.2mol/L的CH3COOH溶液与2L 0.1mol/L的CH3COOH溶液中所含的n(H+)之比 | |
| C. | NaHS溶液中c(Na+)与c(HS-)之比 | |
| D. | pH=12的KOH溶液与pH=12的Ba(OH)2溶液中c(OH-)之比 |