题目内容
9.下列叙述错误的是( )| A. | 常温下,将pH=11的氨水和pH=3的盐酸等体积混合后,所得溶液中各离子浓度的关系是c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 在BaSO4饱和溶液中加入少量的BaCl2溶液产生沉淀,平衡后的溶液中:c(Ba2+)×c(SO42-)>Ksp(BaSO4);c(Ba2+)>c(SO42-) | |
| C. | 某二元酸的电离方程式为H2B═H++HB-,HB-?H++B2-,所以NaHB溶液呈酸性 | |
| D. | 等浓度的NH4HSO4、NH4Cl、NH3.H2O溶液中c(NH4+)逐渐减小 |
分析 A.常温下,HCl是强电解质、NH3.H2O是弱电解质,所以pH=3的盐酸为0.001mol/L,pH=11的氨水浓度大于0.001mol/L,二者等体积混合,氨水有剩余,NH3.H2O电离程度大于NH4+水解程度,所以溶液呈碱性,再结合电荷守恒判断c(Cl-)、c(NH4+)相对大小;
B.硫酸钡饱和溶液中加入氯化钡后的溶液仍然为饱和溶液,则c(Ba2+)•c(SO42-)=Ksp(BaSO4);c(Ba2+)=c(SO42-);
C.HB-能电离但不水解,根据氢离子和氢氧根离子浓度相对大小确定溶液的酸碱性;
D.氢离子抑制了硫酸氢铵中铵根离子的水解、一水合氨的电离程度较小,据此判断铵根离子浓度大小.
解答 解:A.常温下,HCl是强电解质、NH3.H2O是弱电解质,所以pH=3的盐酸为0.001mol/L,pH=11的氨水浓度大于0.001mol/L,二者等体积混合,氨水有剩余,NH3.H2O电离程度大于NH4+水解程度,所以溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Cl-)<c(NH4+),溶液中一水合氨电离程度较小,所以溶液中离子浓度大小顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A正确;
B.在BaSO4饱和溶液中加入少量的BaCl2溶液产生沉淀,反应后的溶液仍然为硫酸钡饱和溶液,则平衡后的溶液中:c(Ba2+)×c(SO42-)=Ksp(BaSO4);c(Ba2+)=c(SO42-),故B错误;
C.根据电离方程式可知:HB-能电离不水解,导致溶液中c(H+)>c(OH-),所以溶液呈酸性,故C正确;
D.NH4HSO4中的氢离子抑制了铵根离子的水解、NH3•H2O的电离程度较小,则等浓度的NH4HSO4、NH4Cl、NH3•H2O溶液中c(NH4+)逐渐减小,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响因素为解答关键,注意掌握电荷守恒、物料守恒等知识在判断离子浓度大小中的应用方法.

| A. | 标准状况下,22.4LSO3含有NA个分子 | |
| B. | 6.4g氧气和3.2g臭氧(O3)混合气体所含有的氧原子数为0.6NA | |
| C. | 过氧化钠与CO2反应时,0.1mol过氧化钠转移的电子数为0.2NA | |
| D. | 标准状况下,2.24L Cl2与过量的稀FeCl2溶液反应,转移电子总数为0.1NA |
| A. | 乙烯的结构简式为CH2CH2,乙烷的结构简式为CH3CH3 | |
| B. | 乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,原子不都在同一平面上 | |
| C. | 乙烯分子中含有碳碳双键,乙烷分子中含有碳碳单键,双键不如单键稳定,导致乙烯的性质比乙烷活泼 | |
| D. | 乙烯分子中因含有不饱和键,导致乙烯能使酸性KMnO4溶液和溴的四氯化碳溶液褪色 |
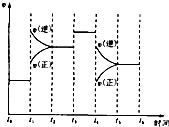 如图表示反应N2(g)+3H2(g)2NH2(g)△H<0.在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
如图表示反应N2(g)+3H2(g)2NH2(g)△H<0.在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )| A. | t5~t6 | B. | t2~t3 | C. | t3~t4 | D. | t0~t1 |
| A. | 稀硫酸中:K+、Mg2+、AlO2-、NO3- | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | $\frac{Kw}{c({H}^{+})}$=10-13 mol•L-1溶液中:Fe3+、NH4+、Mg2+、SO42- | |
| D. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
| A. | CO${\;}_{3}^{2-}$ | B. | HCO${\;}_{3}^{-}$ | C. | CH3COO- | D. | SO${\;}_{3}^{2-}$ |
| A. | 常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0 | |
| B. | 反应 A(g)+3B(g)?2C(g)达平衡后,升高温度,平衡常数增大,则正反应的△H<0 | |
| C. | 已知H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ/mol.将4 g氢氧化钠固体放入100 mL 1 mol/L的稀盐酸中,放出了5.73 kJ的热量 | |
| D. | 检验C2H5Cl中的氯元素:先将C2H5Cl与NaOH溶液混合后加热,冷却后再AgNO3溶液 |
| A. | HCN碳原子为sp杂化,分子为直线型 | |
| B. | CO2分子中碳原子为sp2杂化,分子为V型 | |
| C. | CH2=CH2分子中碳原子为sp3杂化,分子为三角型 | |
| D. | 乙炔分子中碳原子为sp2杂化,分子为直线型 |
| A. | $\frac{10}{11}$ | B. | $\frac{7}{11}$ | C. | $\frac{6}{11}$ | D. | $\frac{4}{11}$ |