题目内容
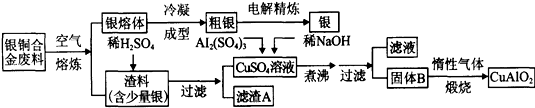
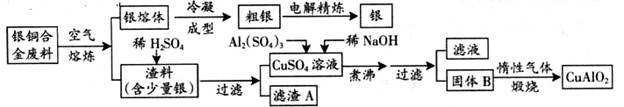
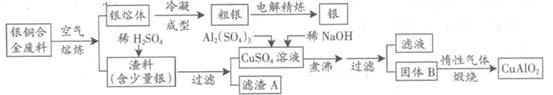
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下图:
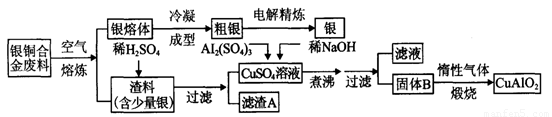
(1)电解精练银时,阴极反应式为_______________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该红棕色气体与水反应的化学方程式为_______________________________________。
(2)固体混合物B的组成为_____________;在生成固体B的过程中,必须控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为_____________________。
(3)煅烧过程中生成的氧化产物与NH3在催化剂条件下反应的化学方程式为_____________________。这个反应中会有白烟产生,该白烟为______________。
(4)若银铜合金中铜的质量分数为64%,理论上3.0kg废料中的铜可完全转化为__________molCuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液___________L。
( 共10分)(1)Ag+ + e-=Ag (1分) 3NO2 +H2O=2HNO3 + NO↑ (1分)
(2)CuO(或Cu(OH)2 ) 和Al(OH)3 (1分) OH― +Al(OH)3=AlO2-+2H2O(1分)
(3)4NH3+5O2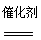 4NO+6H2O(1分) NH4NO3
(1分) (4)30 (1分);15 (1分)
4NO+6H2O(1分) NH4NO3
(1分) (4)30 (1分);15 (1分)
【解析】
试题分析:(1)仿照精炼铜的原理可以确定粗银做阳极:Ag—e—= Ag+,纯银做阴极:Ag++e—= Ag。滤渣A中的金属与稀硝酸反应生成无色的NO,NO与空气中的氧气反应生成红棕色的NO2,NO2与水反应生成硝酸和NO,反应的化学方程式为3NO2 +H2O=2HNO3 + NO↑。
(2)结合信息和流程图分析可知:硫酸铜、硫酸铝固体与稀氢氧化钠反应生成氢氧化铜和氢氧化铝,煮沸时氢氧化铜分解为CuO,氢氧化铝不分解,所以B应该为CuO和Al(OH)3。由于氢氧化铝是两性氢氧化物,所以若NaOH过量,则两性氢氧化物Al(OH)3就会溶解,反应的离子方程式为Al(OH)3+OH—=AlO—+2H2O。
(3)在催化剂的作用下,氨气发生催化氧化生成NO和水,反应的化学方程式为4NH3+5O2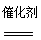 4NO+6H2O。生成的NO在氧气和水的作用下生成硝酸,硝酸与氨气反应生成硝酸铵而冒白烟。
4NO+6H2O。生成的NO在氧气和水的作用下生成硝酸,硝酸与氨气反应生成硝酸铵而冒白烟。
(4)银铜合金中的铜的物质的量n(Cu)=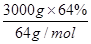 =30mol,根据元素守恒可得生成的CuAlO2也是30.0mol。依据化学式CuAlO2中的Cu和Al个数关系及Al原子个数守恒可得,n[Al2(SO4)3]=
30.0mol÷2=15.0mol,所以需要硫酸铝溶液的体积是15.0mol÷1.0mol/L=15.0L。
=30mol,根据元素守恒可得生成的CuAlO2也是30.0mol。依据化学式CuAlO2中的Cu和Al个数关系及Al原子个数守恒可得,n[Al2(SO4)3]=
30.0mol÷2=15.0mol,所以需要硫酸铝溶液的体积是15.0mol÷1.0mol/L=15.0L。
考点:考查电解原理的应用、物质制备的实验方案设计与评价以及计算、氨气的催化氧化等

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案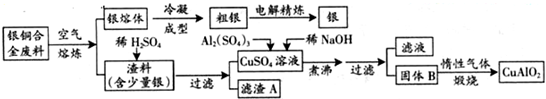
 CuAlO2 + ↑。
CuAlO2 + ↑。