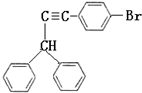
题目内容
(2013?广东)银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如下:
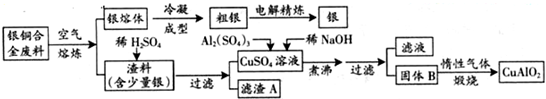
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为
(2)固体混合物B的组成为
(3)完成煅烧过程中一个反应的化学方程式:
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为
(5)CuSO4溶液也可用于制备胆矾,其基本操作是

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为
Ag++e-=Ag
Ag++e-=Ag
;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为2NO+O2=2NO2
2NO+O2=2NO2
.(2)固体混合物B的组成为
Al(OH)3和CuO
Al(OH)3和CuO
;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(3)完成煅烧过程中一个反应的化学方程式:
4
4
CuO+2
2
Al2O3
| ||
4
4
CuAlO2+O2
O2
↑(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为
50.0
50.0
mol CuAlO2,至少需要1.0mol?L-1的Al2(SO4)3溶液25.0
25.0
L.(5)CuSO4溶液也可用于制备胆矾,其基本操作是
蒸发浓缩、冷却结晶
蒸发浓缩、冷却结晶
、过滤、洗涤和干燥.分析:(1)根据电解原理分析判断;无色的NO在常温下与空气中的O2迅速化合生成红棕色N02;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,根据Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃判断产物;根据氢氧化铝显两性能与碱反应;
(3)根据化合价升降总数相等以及原子守恒来配平;
(4)根据铜元素守恒建立关系式:Cu~CuAlO2来计算;根据铝元素守恒建立关系式:Al2(SO4)3~2CuAlO2来计算;
(5)根据可溶性溶质从溶液中析出晶体的方法;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,根据Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃判断产物;根据氢氧化铝显两性能与碱反应;
(3)根据化合价升降总数相等以及原子守恒来配平;
(4)根据铜元素守恒建立关系式:Cu~CuAlO2来计算;根据铝元素守恒建立关系式:Al2(SO4)3~2CuAlO2来计算;
(5)根据可溶性溶质从溶液中析出晶体的方法;
解答:解:(1)电镀法精炼银时,粗银为阳极,精银为阴极,阳极上失电子变成离子进入溶液了:Ag-e-=Ag+,阴极银离子得到电子形成单质银:Ag++e-=Ag;无色的NO在常温下与空气中的O2迅速化合生成红棕色N02:2NO+O2=2NO2;故答案为:Ag++e-=Ag;2NO+O2=2NO2
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO;氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3和CuO;Al(OH)3+OH-=AlO2-+2H2O
(3)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,故答案为:4;2;4;O2
(4)由关系式:Cu~CuAlO2得n(CuAlO2)=
=50.0mol,则CuAlO2为50.0mol,
由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×
=25.0mol,所以需要体积为
=25.0L,
故答案为:50.0;25.0
(5)由CuSO4溶液获得CuSO4?5H2O晶体,需要经过蒸发浓缩,冷却结晶(或结晶),过滤等操作,故答案为:蒸发浓缩、冷却结晶;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO;氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3和CuO;Al(OH)3+OH-=AlO2-+2H2O
(3)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,故答案为:4;2;4;O2
(4)由关系式:Cu~CuAlO2得n(CuAlO2)=
| 5000g×63.5% |
| 64g/mol |
由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×
| 1 |
| 2 |
| 25.0mol |
| 1.0mol?L -1 |
故答案为:50.0;25.0
(5)由CuSO4溶液获得CuSO4?5H2O晶体,需要经过蒸发浓缩,冷却结晶(或结晶),过滤等操作,故答案为:蒸发浓缩、冷却结晶;
点评:本题以从废料中回收银并制备铜化工产品为背景,考查了电解原理、沉淀的判断、氧化还原反应的配平以及化学计算,难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目

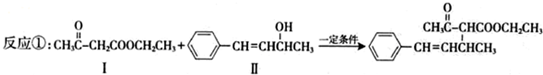
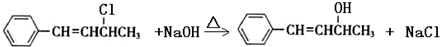
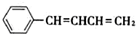
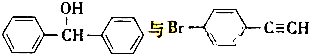 ,也可以发生类似反应①的反应,有机产物的结构简式为
,也可以发生类似反应①的反应,有机产物的结构简式为