题目内容
11.下列操作会导致实验结果偏高的是( )| A. | 中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值 | |
| B. | 中和滴定测定盐酸浓度,量取20.00mL盐酸时未用待测液润洗酸式滴定管 | |
| C. | 用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量 | |
| D. | 配制一定物质的量浓度溶液时,用量筒量取浓溶液体积仰视读数,所配溶液的浓度 |
分析 A.铜是热的良导体,导热能力强于玻璃;
B.未用待测液润洗酸式滴定管,标准液被稀释,消耗的标准液体积偏大;
C.托盘天平称量原理:左盘的质量=右盘的质量+游码的质量;
D.用量筒量取浓溶液体积仰视读数,量取的浓溶液体积偏大.
解答 解:A.铜是热的良导体,用铜制环形搅拌器搅拌溶液,会导致溶液温度偏低,所以测定的中和热偏低,故A不选;
B.未用标准液润洗酸式滴定管,导致标准液的浓度减小,消耗的标准液体积偏大,测定结果偏高,故B选;
C.如果药品和砝码放反,则药品的质量=砝码质量-游码质量=(10-0.5)g=9.5g,所以称量的药品质量偏低,故B不选;
D.用量筒量取浓溶液体积仰视读数,量取的浓溶液体积偏大,所含的溶质的物质的量偏大,溶液的浓度偏高,故D选;
故选:BD.
点评 本题考查了实验的误差分析,明确中和热试验、中和滴定实验、配制一定物质的量浓度溶液的实验的原理是解题关键,题目难度不大,注意托盘天平称量的原理.

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
4.铅蓄电池工作时反应的化学方程式为Pb+PbO2+2H2SO4═2PbSO4+H2O.下列关于该电池的说法正确的是( )
| A. | 铅蓄电池电池是一次电池 | |
| B. | 负极反应式为Pb-2e-═Pb2+ | |
| C. | 连续工作后电解液的酸性将减小 | |
| D. | 工作中,每转移0.2 mol电子时,负极质量减少6.5 g |
5.下列关于有机物的说法中,正确的是( )
| A. | 乙烯、乙炔均能使溴水和酸性高锰酸钾溶液褪色,但褪色的原理不一样 | |
| B. | 石油的分馏、裂化和煤的干馏都是化学变化 | |
| C. | “乙醇汽油”是在汽油里加入适量乙醇而形成的一种燃料,它是一种新型化合物 | |
| D. | 乙炔在实验室制取时,用长颈漏斗将饱和食盐水加入圆底烧瓶中与电石反应 |
2.下列关于元素周期表和元素周期律的说法错误的是( )
| A. | 因为K比Na容易失去电子,所以K比Na的还原性强 | |
| B. | 第二周期元素从Li到F,非金属性逐渐增强 | |
| C. | 在金属和非金属的分界线处,可以找到用于作催化剂的元素 | |
| D. | O与S为同主族元素,且O比S的非金属性强 |
9.下表为元素周期表的一部分用元素符号或化学式回答下列问题.
(1)写出⑥与⑧元素组成的分子的电子式: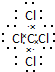 ,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.
,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3;-
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)②和⑧的最高价氧化物对应水化物分别与⑤的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O、Al(OH)3+3H+═Al3++2H2O;
(6)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子 ;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
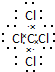 ,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.
,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3;-
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)②和⑧的最高价氧化物对应水化物分别与⑤的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O、Al(OH)3+3H+═Al3++2H2O;
(6)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子
 ;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
16.某溶液与金属铝反应能放出氢气,则在该溶液中一定能大量共存的离子组是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、I-、Cl-、SO42- | ||
| C. | NO3-、Fe3+、Cl-、I- | D. | NO3-、Cl-、Na+、SO32- |
3.下列化学用语书写正确的是( )
| A. | 甲烷的电子式: | B. | 丙烯的键线式: | ||
| C. | 乙醇的结构式: | D. | 乙烯的结构简式:CH2CH2 |
20.下列说法正确的是( )
| A. | O2、O3互为同位素 | |
| B. | 1H、2 H、3 H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同系物 | |
| D. | 乙烷、乙烯互为同分异构体 |
 H3O++CO32-
H3O++CO32-