题目内容
【题目】石油加氢精制和天然气净化等过程产生有毒的H2S,直接排放会污染空气。
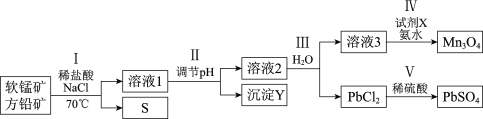
(1)工业上用克劳斯工艺处理含H2S的尾气获得硫黄,流程如下:
![]()
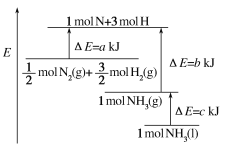
①反应炉中的反应:2H2S(g)+3O2(g) =2SO2(g)+2H2O(g) H=-1035.6 kJ·mol1
催化转化器中的反应:2H2S(g)+SO2(g) = 3S(g)+2H2O(g) H=-92.8 kJ·mol1
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:______。
②为了提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率为______。
(2)科研工作者利用微波法处理尾气中的H2S并回收H2和S,反应为:H2S![]() H2+S,一定条件下,H2S的转化率随温度变化的曲线如图。
H2+S,一定条件下,H2S的转化率随温度变化的曲线如图。
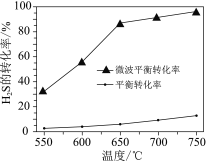
①H2S分解生成H2和S的反应为______反应(填“吸热”或“放热”)。
②微波的作用是______。
(3)某科研小组将微电池技术用于去除天然气中的H2S,装置示意图如下,主要反应:2Fe+2H2S+O2= 2FeS+2H2O(FeS难溶于水),室温时,pH=7的条件下,研究反应时间对H2S的去除率的影响。

①装置中微电池负极的电极反应式:______。
②一段时间后,单位时间内H2S的去除率降低,可能的原因是______。
【答案】2H2S(g)+O2(g) = 2S(g)+2H2O(g) H=-407.1 kJ·mol1 ![]() 或33.3% 吸热 微波使H2SH2+S的化学平衡向正反应方向移动,提高平衡转化率 Fe-2e-+H2S= FeS+2H+ 生成的FeS附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢;铁的量因消耗而减少,形成微电池的数量减少,化学反应速率减慢
或33.3% 吸热 微波使H2SH2+S的化学平衡向正反应方向移动,提高平衡转化率 Fe-2e-+H2S= FeS+2H+ 生成的FeS附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢;铁的量因消耗而减少,形成微电池的数量减少,化学反应速率减慢
【解析】
(1) ①根据盖斯定律书写总反应的热化学方程式;
②为了提高H2S转化为S的比例,催化转化器中H2S(g)、SO2(g)应恰好完全反应;
(2)根据图示,随温度升高,H2S的平衡转化率增大;相同温度下,利用微波法处理尾气H2S的平衡转化率大。
(3)根据总反应2Fe+2H2S+O2= 2FeS+2H2O,Fe失电子发生氧化反应,所以Fe是负极;从影响反应速率的角度分析单位时间内H2S的去除率降低的原因。
(1) ① 反应Ⅰ:2H2S(g)+3O2(g) =2SO2(g)+2H2O(g) H=-1035.6 kJ·mol1
反应Ⅱ:2H2S(g)+SO2(g) = 3S(g)+2H2O(g) H=-92.8 kJ·mol1
根据盖斯定律Ⅰ×![]() +Ⅱ×
+Ⅱ×![]() 得 2H2S(g)+O2(g) = 2S(g)+2H2O(g) H=-407.1 kJ·mol1;
得 2H2S(g)+O2(g) = 2S(g)+2H2O(g) H=-407.1 kJ·mol1;
②为了提高H2S转化为S的比例,催化转化器中H2S(g)、SO2(g)应恰好完全反应,假设催化转化器中参加反应的H2S(g)的物质的量为2mol,SO2的物质的量是1mol,即反应炉中需要生成1molSO2,反应炉中参加反应的H2S的物质的量为1mol,所以理论上应控制反应炉中H2S的转化率为![]() ;
;
(2) ①根据图示,随温度升高,H2S的平衡转化率增大,说明升高温度,平衡正向移动,正反应为吸热反应;
②根据图示,相同温度下,利用微波法处理尾气H2S的平衡转化率大,所以微波的作用是使H2SH2+S的化学平衡向正反应方向移动,提高平衡转化率;
(3) ①根据总反应2Fe+2H2S+O2= 2FeS+2H2O,Fe发生氧化反应, Fe是原电池负极,负极反应式是Fe-2e-+H2S= FeS+2H+;
②负极生成的FeS附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢;铁的量因消耗而减少,形成微电池的数量减少,化学反应速率减慢,所以一段时间后,单位时间内H2S的去除率降低。

【题目】砷(![]() )元素广泛的存在于自然界,在周期表中的位置如表。
)元素广泛的存在于自然界,在周期表中的位置如表。
|
| |
|
| |
|
|
完成下列填空:
(1)砷元素最外层电子的排布式为______________。
(2)砷化镓(![]() )和氮化硼(
)和氮化硼(![]() )晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,
)晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,![]() 的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
(3)亚砷酸盐(![]() )在碱性条件下与碘单质反应生成砷酸盐(
)在碱性条件下与碘单质反应生成砷酸盐(![]() ),完成反应的离子方程式: ____
),完成反应的离子方程式: ____![]() +I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
+I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
(4)工业上将含有砷酸盐(![]() )的废水转化为粗
)的废水转化为粗![]() 的工业流程如下:
的工业流程如下:
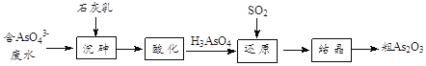
①写出还原过程中砷酸![]() 转化为亚砷酸
转化为亚砷酸![]() 的化学方程式: ___________
的化学方程式: ___________
②“沉砷”是将![]() 转化为
转化为![]() 沉淀,主要反应有:
沉淀,主要反应有:
i.Ca(OH)2(s)Ca2+(aq)+2OH—(aq)+Q
ii.5Ca2++OH—+3![]() Ca5(AsO4)3OH-Q
Ca5(AsO4)3OH-Q
沉砷最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因___。