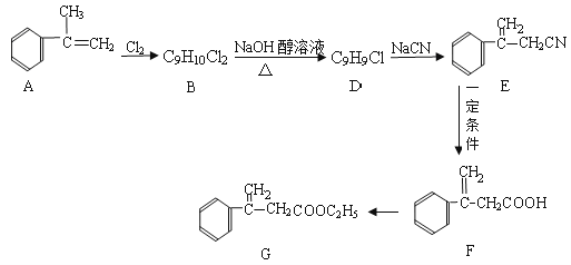
题目内容
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入酸性KMnO4溶液 | 溶液褪色 | SO2具有漂白性 |
B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀产生,苯层呈紫红色 | Cu2+有氧化性,白色沉淀可能为CuI |
C | 向蛋白质溶液中分别加入甲醛、(NH4)2SO4饱和溶液 | 均有白色沉淀生成 | 蛋白质均发生了变性 |
D | 向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液 | 出现血红色 | 反应2Fe3++2I |
A.AB.BC.CD.D
【答案】BD
【解析】
A. SO2气体通入酸性KMnO4溶液,溶液褪色,是因为SO2具有还原性,SO2与酸性KMnO4发生氧化还原反应而使酸性KMnO4溶液褪色,A项错误;
B.CuSO4溶液中加入KI溶液,发生氧化还原反应生成碘单质和CuI,则现象为有白色沉淀生成,苯层呈紫红色,B项正确;
C.蛋白质溶液中加入(NH4)2SO4饱和溶液产生白色沉淀,是蛋白质发生盐析,而加入甲醛,是蛋白质变性,C项错误;
D.向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,发生反应2Fe3++2I![]() 2Fe2++I2,I过量,滴加5滴KSCN溶液,出现血红色,说明有Fe3+剩余,则说明反应2Fe3++2I
2Fe2++I2,I过量,滴加5滴KSCN溶液,出现血红色,说明有Fe3+剩余,则说明反应2Fe3++2I![]() 2Fe2++I2是有一定限度的,D项正确。
2Fe2++I2是有一定限度的,D项正确。
答案选BD。

【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm![]() ,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
(6)a形成的某种单质的层状结构如图,其中a原子数、a—a键数、六元环数之比为____。