题目内容
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2FeO4).据此回答问题:
(1)试剂a为
A.浓硫酸 B.硫酸铁溶液 C.氯水 D.H2O2和稀硫酸 E.Fe
(2)加入过量试剂c,发生反应的离子方程式为
(3)K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为
(4)高铁电池是一种新型可充电电池,总反应为:3Zn+2K2FeO4+8H2O
| 放电 | 充电 |
分析:(1)试剂a要满足可以把铜单质氧化生成硫酸铜、不引入关键杂质离子(例如Fe2+、Fe3+)且不污染环境等条件.由已知终端产物金属铜和硫酸铁溶液反推可知固体X和溶液Y,从而确定试剂b;
(2)由CuSO4溶液和溶液Y(FeSO4溶液)可知试剂c为硫酸铁溶液,KMnO4溶液可腐蚀橡胶;
(3)3O2~4FeO42-~4Fe(OH)3~4×3e-,计算出O2的物质的量代入比例式即可,K2FeO4除与水反应生成4Fe(OH)3(胶体)之外,还具有强氧化性;
(4)该电池放电时正极反应式为总反应式放电方向的还原反应部分.
(2)由CuSO4溶液和溶液Y(FeSO4溶液)可知试剂c为硫酸铁溶液,KMnO4溶液可腐蚀橡胶;
(3)3O2~4FeO42-~4Fe(OH)3~4×3e-,计算出O2的物质的量代入比例式即可,K2FeO4除与水反应生成4Fe(OH)3(胶体)之外,还具有强氧化性;
(4)该电池放电时正极反应式为总反应式放电方向的还原反应部分.
解答:解:(1)试剂a要满足可以把铜单质氧化生成硫酸铜、不引入关键杂质离子(例如Fe2+、Fe3+)且不污染环境等条件,废旧电路板与试剂a反应能够生成硫酸铜溶液的有A、B、D三种试剂,但A浓硫酸与铜反应就需要加热,而且反应还会产生SO2污染空气,B硫酸铁溶液与铜反应会产生Fe2+、Fe3+杂质离子;由已知硫酸铁溶液反推可知溶液Y为FeSO4溶液,由CuSO4溶液与试剂b反应生成FeSO4溶液和固体X不难推出试剂b为Fe,固体X为铜和过量铁粉,
故答案为:D;E;
(2)由CuSO4溶液和溶液Y(FeSO4溶液)可知试剂c为硫酸铁溶液,2Fe3++Cu=2Fe2++Cu2+;Fe3+与SCN-反应生成红色的Fe(SCN)3,通常用KSCN溶液来检验Fe3+;一定物质的量浓度溶液的配制实验用到的主要仪器就是容量瓶,KMnO4溶液具有强氧化性,可腐蚀橡胶管,所以强氧化性及酸性溶液应加入酸式滴定管,
故答案为:2Fe3++Cu=2Fe2++Cu2+;KSCN;容量瓶;酸式;
(3)氧气的物质的量n═
═
═0.5mol,据3O2~4FeO42-~4Fe(OH)3~4×3e-可得转移电子的物质的量为:0.5mol×
═2mol;FeCl3净水是由于Fe3+生成Fe(OH)3胶体,Fe(OH)3胶体能吸附水中的悬浮物而达到净水目的,K2FeO4除与水反应生成Fe(OH)3(胶体)之外,还具有强氧化性,可以杀菌消毒,
故答案为:2mol; K2FeO4;高铁酸钾(K2FeO4)具有强氧化性,在净水的同时还能杀菌消毒;
(4)该电池放电时负极电极反应式为:3Zn-6e-+6OH-=3Zn(OH)2,总反应离子方程式减去负极电极反应式,化简化学计量数得正极电极反应式为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-,
故答案为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-.
故答案为:D;E;
(2)由CuSO4溶液和溶液Y(FeSO4溶液)可知试剂c为硫酸铁溶液,2Fe3++Cu=2Fe2++Cu2+;Fe3+与SCN-反应生成红色的Fe(SCN)3,通常用KSCN溶液来检验Fe3+;一定物质的量浓度溶液的配制实验用到的主要仪器就是容量瓶,KMnO4溶液具有强氧化性,可腐蚀橡胶管,所以强氧化性及酸性溶液应加入酸式滴定管,
故答案为:2Fe3++Cu=2Fe2++Cu2+;KSCN;容量瓶;酸式;
(3)氧气的物质的量n═
| V |
| Vm |
| 11.2L |
| 22.4L/mol |
| 4×3 |
| 3 |
故答案为:2mol; K2FeO4;高铁酸钾(K2FeO4)具有强氧化性,在净水的同时还能杀菌消毒;
(4)该电池放电时负极电极反应式为:3Zn-6e-+6OH-=3Zn(OH)2,总反应离子方程式减去负极电极反应式,化简化学计量数得正极电极反应式为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-,
故答案为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-.
点评:本题考查铜、铁及其重要化合物、Fe3+检验、容量瓶滴定管的使用、净水原理、转移电子的计算、电极反应式的书写等知识,考查综合全面,熟知铜、铁单质及其离子的转化是解题关键,转移电子的计算和正极电极反应式的书写是难点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题: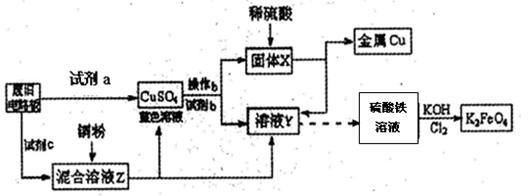
据此回答问题
(1)试剂a为 试剂b为 (填写所选试剂代号)
| A.浓硫酸 | B.硫酸铁溶液 | C.氯水 | D.H2 O2和稀硫酸 E. Fe |
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O="=" 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为 。K2Fe04与FeCl3相比,净水效果更好的是_ ,理由是 。
(4)高铁电池是一种新型可充电电池,总反应为:3Zn +2K2FeO4 +8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。 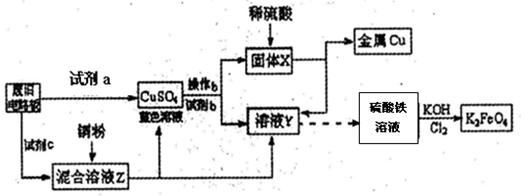
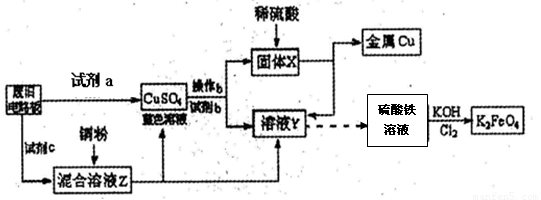
 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。