题目内容
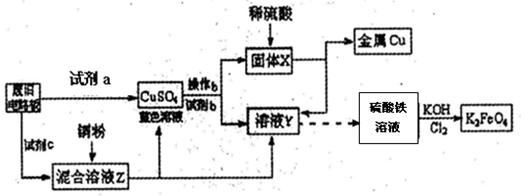
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题:
据此回答问题
(1)试剂a为 试剂b为 (填写所选试剂代号)
A.浓硫酸 B.硫酸铁溶液 C.氯水 D.H2 O2和稀硫酸 E. Fe
(2)加入过量试剂c,发生反应的离子方程式为__ ;溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为__ _ _(填化学式);欲测定溶液Z中Fe2+的浓度,需要用(填仪器名称)__ __配制一定浓度的KMnO4标准溶液。在滴定时KMnO4标准溶液应加入到 (填“酸式”或“碱式”)滴定管中。
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O== 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为 。K2Fe04与FeCl3相比,净水效果更好的是_ ,理由是 。
(4)高铁电池是一种新型可充电电池,总反应为:3Zn +2K2FeO4 +8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。
(1)D(1分) E(1分)
(2)2Fe3++Cu=2Fe2++Cu2+(2分) KSCN(或NH4SCN等,1分)
容量瓶(1分) 酸式(1分)
(3)2mol(2分) K2FeO4(1分)
高铁酸钾(K2FeO4)具有强氧化性,在净水的同时还能杀菌消毒(2分)
(4)K2FeO4(2分)
解析:
略

根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题: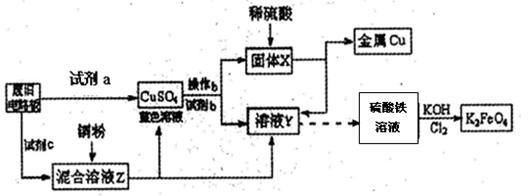
据此回答问题
(1)试剂a为 试剂b为 (填写所选试剂代号)
| A.浓硫酸 | B.硫酸铁溶液 | C.氯水 | D.H2 O2和稀硫酸 E. Fe |
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O="=" 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为 。K2Fe04与FeCl3相比,净水效果更好的是_ ,理由是 。
(4)高铁电池是一种新型可充电电池,总反应为:3Zn +2K2FeO4 +8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。 
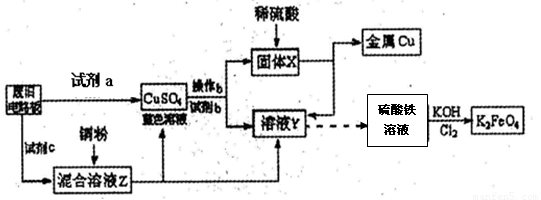
 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是: 。