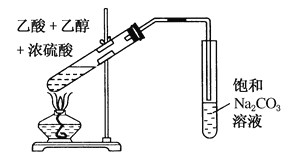
题目内容
【题目】近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

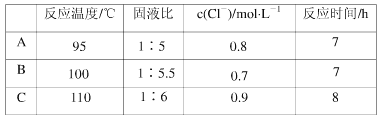
反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图~如图所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2![]() 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S![]() 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成a molCu,共消耗________ mol O2。
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成a molCu,共消耗________ mol O2。
(2)写出反应1的化学方程式:________________。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________。
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________(填字母代号)。
【答案】(1) S 1.2 2.5a
(2)2CuS+O2+2H2SO4![]() CuSO4+2H2O+2S 污染小,同时得到副产物硫酸亚铁晶体及硫黄,资源得到充分利用
CuSO4+2H2O+2S 污染小,同时得到副产物硫酸亚铁晶体及硫黄,资源得到充分利用
(3)蒸发浓缩、冷却结晶(过滤不写不扣分) (4) A
【解析】(1)①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO中S元素的化合价从+2升高为+4价,被氧化;②2Cu2S+3O2
Cu2S+3SO2+2FeO中S元素的化合价从+2升高为+4价,被氧化;②2Cu2S+3O2![]() 2Cu2O+2SO2中S元素的化合价从-2升高为+4价,被氧化;③2Cu2O+Cu2S
2Cu2O+2SO2中S元素的化合价从-2升高为+4价,被氧化;③2Cu2O+Cu2S![]() 6Cu+SO2↑中S元素的化合价从+2升高为+4价,被氧化;则在反应①、②、③中被氧化的元素为S元素;若生成的SO2在标准状况下体积为4.48L,生成SO2的物质的量为
6Cu+SO2↑中S元素的化合价从+2升高为+4价,被氧化;则在反应①、②、③中被氧化的元素为S元素;若生成的SO2在标准状况下体积为4.48L,生成SO2的物质的量为![]() =0.2mol,则发生转移的电子数目为0.2mol×6NA=1.2NA;amolCuFeS2生成
=0.2mol,则发生转移的电子数目为0.2mol×6NA=1.2NA;amolCuFeS2生成![]() molCu2S,消耗2amolO2,
molCu2S,消耗2amolO2,![]() amolCu2S氧化为Cu2O,消耗O2
amolCu2S氧化为Cu2O,消耗O2![]() amol
amol![]() =0.5amol,共消耗2.5amolO2;
=0.5amol,共消耗2.5amolO2;
(2)依据流程转化可知,反应Ⅰ是硫化铜和氧气、硫酸发生氧化还原反应生成硫酸铜、硫和水,反应的化学方程式为:2CuS+O2+2H2SO4=2CuSO4+2S+2H2O,火法炼钢中产生有毒的二氧化硫,而湿法炼铜中不产生有毒气体,故其污染性小、环保,同时湿法炼铜还得到副产品硫酸亚铁晶体及其硫磺,充分利用了资源;
(3通过将溶液蒸发浓缩、冷却结晶并过滤即可得到FeSO4·7H2O;
(4)从图1可以看出,铜的浸出率随反应温度升高二增大,在为的达到95°C后,铜的浸出率随温度的变化不明显,但温度过高能耗增加,由此可知适应的反应温度为95°C,图3可以看出:固液比大于1︰5时,铜的浸出率随固液比的增大而有所减小;固液比小于1︰5时铜的浸出率随固液比的减小而有所下降,因此适宜的固液比为1︰5;从图4可以看出铜的浸出率随反应时间增大而增大,但在反应时间超出7h后,随反应时间的延长铜的浸出率增大的很缓慢,同时反应时间过长,即增加能耗,有降低设备利用率,故适宜的反应时间7h;表中数据变化分析,加入氯离子能改变铜的浸出效果,但氯离子浓度超过0.8mol/L,时铜的浸出率随氯离子浓度增加反而减小,故适宜的氯离子浓度维持在0.8mol/L;
故答案为A。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。