题目内容
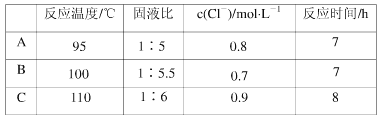
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )。
A. 常压下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. Y的氢化物的沸点比H2O的沸点高
D. Y元素的非金属性比W元素的非金属性强
【答案】D
【解析】由五种元素在周期表中的位置图可知,X为N元素,W为P元素,Y为S元素,Z为Br元素,R为Ar元素。
A项,常压下五种元素的单质中,W单质的沸点最高,故A错误;B项,S2-(Y2-)离子结构示意图: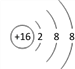 ,Br-(Z-)离子结构示意图:
,Br-(Z-)离子结构示意图: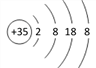 ,Ar(R)原子结构示意图:
,Ar(R)原子结构示意图: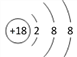 ,所以Y的阴离子电子层结构与R原子的相同,Z的阴离子电子层结构与R原子的不同,故B错误;C项,H2S的沸点比H2O的沸点低,故C错误;D项,同周期,随着原子序数的递增,元素的非金属性增强,所以Y元素(S)的非金属性比W元素(P)的非金属性强,故D正确。综上,选D。
,所以Y的阴离子电子层结构与R原子的相同,Z的阴离子电子层结构与R原子的不同,故B错误;C项,H2S的沸点比H2O的沸点低,故C错误;D项,同周期,随着原子序数的递增,元素的非金属性增强,所以Y元素(S)的非金属性比W元素(P)的非金属性强,故D正确。综上,选D。

【题目】煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
5 | 0.80 | |
10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________。
②列式并计算该反应在700℃时的化学平衡常数K=__________,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________(填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4![]() 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3![]() 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀