题目内容
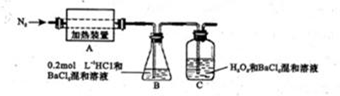
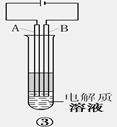
Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
(1)请结合化学平衡移动原理解释B中溶液的作用 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是 。
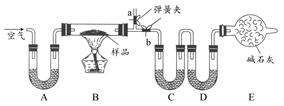
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器b中可选择的试剂为(任意填一种) 。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为 。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积 (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据 (填序号)。
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是 。
Ⅰ.(1)CO2在水中存在平衡:CO2+H2O H2CO3
H2CO3 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(3分)[给分要点:吸收HCl气体、减少CO2在水中的溶解、H2SO4电离出的H+使平衡左移]
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(3分)[给分要点:吸收HCl气体、减少CO2在水中的溶解、H2SO4电离出的H+使平衡左移]
(2)2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O(3分)
Ⅱ.(1)碱石灰或生石灰或氢氧化钠固体(任意填一种)(2分)
(2)Cu和Cu2O(3分) (3)偏小(2分) (4)b、c(3分)
(5)防止F中水蒸气进入D中,并吸收氨气(2分)
解析试题分析:Ⅰ.(1)7mol?L?1的盐酸与CaCO3反应制取的CO2气体中含有HCl,硫酸溶液可吸收HCl,CO2能溶于水,存在平衡::CO2+H2O H2CO3
H2CO3 HCO3-+H+,H2SO4电离产生H+,使上述平衡向左移动,从而减少CO2在水中的溶解。
HCO3-+H+,H2SO4电离产生H+,使上述平衡向左移动,从而减少CO2在水中的溶解。
(2)当D中有大量白色固体析出时,CO2、H2O与Na2CO3反应生成了NaHCO3,加入BaCl2溶液,出现白色沉淀为BaCO3,产生的气体为CO2,离子方程式为:2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O
Ⅱ.(1)碱石灰或生石灰或氢氧化钠固体都能与浓氨水作用,产生氨气。
(2)若CuO全部被还原为Cu,根据关系式:CuO ~ Cu,生成的Cu质量为:80g×64/80=64g;若CuO全部被还原为Cu2O,根据关系式:2CuO ~ Cu2O,生成的Cu2O质量为:80g×144/160=72g,实际得到红色固体质量为68g,则红色固体成分为Cu和Cu2O
(3)F中左边液面低于右边液面,说明左边气体压强大于右边,则会导致读取的气体体积偏小。
(4)F装置实验前后液面差VL,为NH3与CuO反应生成的N2的体积,可求出N原子的物质的量,D装置实验前后质量差mg,为NH3与CuO反应生成的H2O的质量,可求出H原子的物质的量,由二者可求出氨气分子中氮、氢原子个数比。
(5)因为D中碱石灰的作用是吸收NH3与CuO反应生成的H2O,所以E中浓硫酸可F中水蒸气进入D中,并吸收未反应的氨气。
考点:本题考查化学实验的分析、产物的判断、试剂的选择与作用、离子方程式的书写。

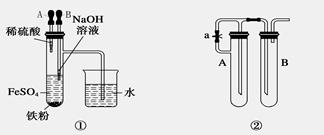
大型钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料。 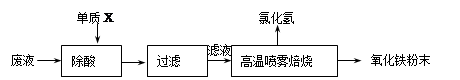
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末。有关的化学方程式为:
(3)某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种。请设计实验探究该铁红涂料中添加的物质。
①提出合理假设
假设1:添加了CuO。 假设2:添加了FeO。
②基于假设 (填“1”或“2”),设计实验方案,进行实验。在答题卡上写出实验步骤、预期现象和结论。
限选实验试剂:铁粉、3mol?L-1H2SO4、0.01 mol?L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中,_________________ ____________________________________________ | ___________________________ |
| 步骤2. ____________________________________________ | ___________________________ |
(4)用水吸收“高温喷雾焙烧”时产生的氯化氢气体可得到盐酸。请计算:用1000g水需吸收标准状况下多少升氯化氢气体可得到36.5%的浓盐酸?(写出计算过程,结果可用数学表达式表示,不必化简)。
(18分)实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液。
方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是___________ (填编号)。
| A.CaCl2溶液 | B.MgSO4溶液 | C.NaCl溶液 | D.Ba(OH)2溶液 |
(3) 过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯外,还有________________________。
(4) 将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算w(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)________________(填偏大或偏小、无影响)。
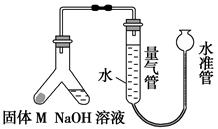
方案二:量气法。量取10.00mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积,由此计算混合物中w (Na2CO3)。
(1)装置中导管a的作用是 。
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①_______________________________,
②_________________________________,
③眼睛视线与液面最低处相平。
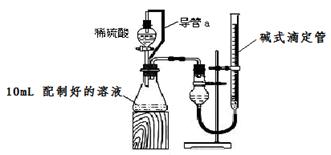
(3)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则 产生CO2的体积为 mL。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L盐酸进行滴定到终点(已知终点时反应H++CO32- =HCO3-恰好完全)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。
(1)量取25.00 mL配制好的溶液,应选择_______________仪器来完成。
(2)判断滴定终点的依据是_____________________。
(3)此法测得w(Na2CO3)= %。
某研究性学习小组在网上收集到信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在 其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘 附着白色物质。
(1)通过钠在CO2气体中燃烧的实验,你认为燃烧的条件是:
_________________________________________________________________。
(2)燃烧的本质是:_____________________________________________。
(3)2010年8月初发生的俄罗斯森林大火着火面积比伦敦市的面积还要大。控制森林火灾是世界性难题。根据燃烧的条件,请你解释为什么设置森林防火隔离带能有效阻止森林火灾的蔓延:_____________________________________________________________。
【提出假设】
假设1:白色物质是Na2O
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物
【设计实验方案·验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
【思考与交流】
(4)甲同学认为方案1得到的结论不正确,其理由是:___________________________________
(5)乙同学认为方案2得到的结论正确,白色物质为:________。
(6)通过方案1和方案2的实验,你认为上述三个假设中,________成立。你的理由是:_____________________________________________________。
(7)钠在二氧化碳中燃烧的化学方程式为:____________________________
(8)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:
________________________________________________________