题目内容
13.已知反应①SO3+H2O=H2SO4;②Cl2+H2O=HCl+HClO;③2F2+2H2O=4HF+O2; ④2Na+2H2O=2NaOH+H2↑,根据上述反应,试回答:(1)上述反应中不属于氧化还原反应有①.(填序号,下同)
(2)H2O被氧化的是③,被还原的是④
(3)是氧化还原反应,但水既不被氧化,又不被还原的是②.
分析 含元素化合价变化的反应为氧化还原反应,水被氧化,则水中O元素的化合价升高,水被还原,则水中H元素的化合价降低;若水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原,以此解答该题.
解答 解:(1)只有①反应中没有元素的化合价变化,不属于氧化还原反应,故答案为:①;
(2)只有③水中O元素的化合价升高,水被氧化;只有④水中H元素的化合价降低,水被还原;故答案为:③;④;
(3)只有②中属于氧化还原反应,但水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原,故答案为:②.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.能说明苯环中不存在单双建交替结构的事实是( )
| A. | 邻位二氯取代产物只有一种 | |
| B. | 间位二氯取代产物只有一种 | |
| C. | 对位二氯取代产物只有一种 | |
| D. | 苯既能发生取代反应也能发生加成反应 |
18.下列物质属电解质的是( )
| A. | 苛性钠 | B. | 碱石灰 | C. | 盐酸 | D. | 铝 |
5.把0.05mol NaOH晶体分别加入到下列100mL液体中,溶液导电性变化最大的是( )
| A. | 自来水 | B. | 0.5 mol/L盐酸 | C. | 0.5 mol/LH2SO4 | D. | 0.5 mol/L NaNO3 |
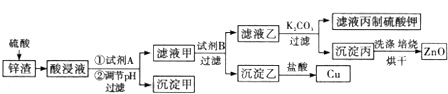
2.工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
有关氢氧化物开始沉淀和沉淀完全的pH见下表
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条)搅拌、适当升温、将废渣碾细成粉末
(2)试剂A是H2O2(填化学式).
(3)调节酸浸液的pH的范围是3.7~5.4.
(4)滤液甲与试剂B发生置换反应,则试剂B是Zn(填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是坩埚.

有关氢氧化物开始沉淀和沉淀完全的pH见下表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(2)试剂A是H2O2(填化学式).
(3)调节酸浸液的pH的范围是3.7~5.4.
(4)滤液甲与试剂B发生置换反应,则试剂B是Zn(填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是坩埚.


 和
和