题目内容
【题目】如图是实验室中制备气体或验证气体性质的装置图。
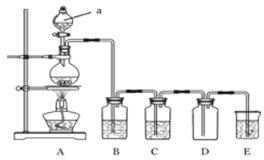
(1)发生装置A中制取氯气的化学方程式 。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+。
装置B中的溶液的作用是 ;装置D中加的最佳试剂是(填序号) 。
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.无水氯化钙 d.KSCN与 FeCl2的混合溶液
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液,C中加品红溶液,D中应加入足量的 (填溶液名称),E中加入 溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为 。
(5)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入适量(填字母) ,能产生白色沉淀。
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.氯化钠溶液
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)除去氯气中的氯化氢;d
(3)酸性高锰酸钾溶液,Na2SiO3
(4)D中高锰酸钾溶液不褪色,E中溶液变浑浊;
(5)AC
【解析】
试题分析:(1)A中加热二氧化锰与浓盐酸反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,可以用盛有饱和食盐除去氯气中的氯化氢;本实验目的之一为证明氧化性,氯气氧化二价铁离子生成三价铁离子,检验三价铁离子通常用硫氰酸钾,所以选:d;故答案为:除去氯气中的氯化氢;d;
(3)元素的非金属性越强,最高价氧化物对应的水化物酸性越强,利用碳酸的酸性强于硅酸,二氧化碳能与硅酸钠反应制得硅酸沉淀,由于CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,需要酸性高锰酸钾溶液除去,防止干扰检验二氧化碳;故答案为:酸性高锰酸钾溶液,Na2SiO3;
(4)若D中高锰酸钾溶液不褪色,说明二氧化硫除尽,E中溶液变浑浊,说明含有二氧化碳气体;空气中含有二氧化碳,可能干扰实验,故应排除空气中二氧化碳的干扰,将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管可排除空气中二氧化碳的干扰,故答案为:D中高锰酸钾溶液不褪色,E中溶液变浑浊;将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥;
(5)A.在试管里加入氨水后,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与氯化钡可生成亚硫酸钡白色沉淀,故A正确;B.足量的SO2通入装有氯化钡溶液的试管,再加稀盐酸无沉淀产生,故B错误;C.足量的SO2通入装有氯化钡溶液的试管,溶液呈酸性,硝酸钾中的硝酸根离子在酸性条件下,有强氧化性,可以将SO2氧化成硫酸根,再与氯化钡产生硫酸钡白色沉淀,故C正确;D.氯化钠与亚硫酸钠溶液不发生反应,故D错误;故答案为:AC。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案