题目内容
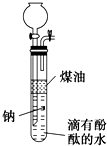 如图是一种隔绝空气条件下钠与水反应的实验装置.实验时,先往大试管中加入适量煤油,取绿豆粒大小的金属钠放入大试管后塞上橡皮塞(这时止水夹处于关闭状态),再通过漏斗加入适量的滴有酚酞的水.回答下列问题:
如图是一种隔绝空气条件下钠与水反应的实验装置.实验时,先往大试管中加入适量煤油,取绿豆粒大小的金属钠放入大试管后塞上橡皮塞(这时止水夹处于关闭状态),再通过漏斗加入适量的滴有酚酞的水.回答下列问题:(1)实验前怎样检验该装置的气密性?
关闭止水夹,向漏斗中加入水,直至漏斗内液面高于试管内液面,持续一段时间后,液面仍保持一定高度差,说明气密性良好(其他合理答案也可)
关闭止水夹,向漏斗中加入水,直至漏斗内液面高于试管内液面,持续一段时间后,液面仍保持一定高度差,说明气密性良好(其他合理答案也可)
.(2)金属钠投入煤油后的现象是
沉入煤油底部
沉入煤油底部
.(3)通过漏斗加入滴有酚酞的水后的现象是
剧烈反应,产生气泡,钠在两种液面间上下跳动,直至消失,下层溶液变红色
剧烈反应,产生气泡,钠在两种液面间上下跳动,直至消失,下层溶液变红色
;反应结束时,漏斗与试管中液面高度的关系是漏斗中液面高于试管中液面
漏斗中液面高于试管中液面
;若将滴有酚酞的水换成硫酸铜溶液,则产生的现象中,不同于原来的实验现象有有蓝色沉淀生成
有蓝色沉淀生成
.(4)为了获得较纯的气体产物,其操作方法是
反应初期打开止水夹,待排出液面上面的空气后再关闭止水夹(或验纯后再收集)
反应初期打开止水夹,待排出液面上面的空气后再关闭止水夹(或验纯后再收集)
.分析:(1)根据常见检验该装置的气密性的方法完成;
(2)根据金属钠的密度分析金属钠投入煤油后的现象;
(3)金属钠与水反应生成氢氧化钠和氢气,溶液显示碱性,试管中压强增大,
(4)打开止水夹将试管中的空气排净后就可以得到纯净的氢气.
(2)根据金属钠的密度分析金属钠投入煤油后的现象;
(3)金属钠与水反应生成氢氧化钠和氢气,溶液显示碱性,试管中压强增大,
(4)打开止水夹将试管中的空气排净后就可以得到纯净的氢气.
解答:解:(1)实验前检验该装置的气密性方法为:关闭止水夹,向漏斗中加入水,直至漏斗内液面高于试管内液面,持续一段时间后,液面仍保持一定高度差,说明气密性良好,
故答案为:关闭止水夹,向漏斗中加入水,直至漏斗内液面高于试管内液面,持续一段时间后,液面仍保持一定高度差,说明气密性良好(其他合理答案也可);
(2)由于金属钠的密度大于煤油的密度,所以金属钠投入煤油后,钠沉入煤油底部,
故答案为:沉入煤油底部;
(3)通过漏斗加入滴有酚酞的水后,金属钠与水剧烈反应,有气泡产生,钠在两种液面间上下跳动,直至消失,下层溶液变红色;反应结束时,由于试管中压强增大,漏斗中的液面高于试管中的液面;若将滴有酚酞的水换成硫酸铜溶液,除了以上现象外,溶液中含有氢氧化铜蓝色沉淀生成,
故答案为:剧烈反应,产生气泡,钠在两种液面间上下跳动,直至消失,下层溶液变红色;漏斗中液面高于试管中液面;有蓝色沉淀生成;
(4)为了获得较纯的气体产物,反应初期打开止水夹,待排出液面上面的空气后再关闭止水夹(或验纯后再收集),
故答案为:反应初期打开止水夹,待排出液面上面的空气后再关闭止水夹(或验纯后再收集).
故答案为:关闭止水夹,向漏斗中加入水,直至漏斗内液面高于试管内液面,持续一段时间后,液面仍保持一定高度差,说明气密性良好(其他合理答案也可);
(2)由于金属钠的密度大于煤油的密度,所以金属钠投入煤油后,钠沉入煤油底部,
故答案为:沉入煤油底部;
(3)通过漏斗加入滴有酚酞的水后,金属钠与水剧烈反应,有气泡产生,钠在两种液面间上下跳动,直至消失,下层溶液变红色;反应结束时,由于试管中压强增大,漏斗中的液面高于试管中的液面;若将滴有酚酞的水换成硫酸铜溶液,除了以上现象外,溶液中含有氢氧化铜蓝色沉淀生成,
故答案为:剧烈反应,产生气泡,钠在两种液面间上下跳动,直至消失,下层溶液变红色;漏斗中液面高于试管中液面;有蓝色沉淀生成;
(4)为了获得较纯的气体产物,反应初期打开止水夹,待排出液面上面的空气后再关闭止水夹(或验纯后再收集),
故答案为:反应初期打开止水夹,待排出液面上面的空气后再关闭止水夹(或验纯后再收集).
点评:本题考查了碱金属及其化合物的性质,题目难度中等,注意掌握碱金属及其化合物性质,该题是高考中的常见题型,试题基础性强,在注重对学生基础知识训练和检验的同时,侧重对学生实验答题能力的培养和方法与技巧的指导和训练,有利于提高学生的实验设计能力和应试能力,提升学生的学科素养.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
 ,如图是一种形状酷似
,如图是一种形状酷似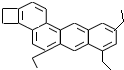 一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”.
一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”.

 如图是一种以某燃料电池为电源,对氯化钠溶液进行电解的装置.该燃料电池的电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2),在熔融状态下能传导O2-.
如图是一种以某燃料电池为电源,对氯化钠溶液进行电解的装置.该燃料电池的电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2),在熔融状态下能传导O2-.