题目内容
(14分)研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (写出一种即可)。
(4)如图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式 。

(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为 。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是 。
(14分)(每空2分)
(1)5CO(g) + I2O5(s)=5CO2(g) + I2(s) △H=-1377.22kJ·mol-1
(2)b 2.67或8/3
(3)(NH4)3PO4或(NH4)2HPO4或NH4H2PO4
(4)O2 + 4e-+2CO2 = 2CO32-
(5)①1∶7
②对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应
【解析】能说明反应NO2+SO2 SO3+NO达到平衡状态:压强不变不作为判断依据,SO3和NO的体积比保持不变不可以作为判断的依据。每消耗1 mol SO2的同时消耗1 molNO是平衡状态的标志。平衡常数K=0.82/0.5×1.25=2.67.用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g
SO3+NO达到平衡状态:压强不变不作为判断依据,SO3和NO的体积比保持不变不可以作为判断的依据。每消耗1 mol SO2的同时消耗1 molNO是平衡状态的标志。平衡常数K=0.82/0.5×1.25=2.67.用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
X X X
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
Y 0.5y
X+0.5Y=1 /28X+46(X+Y)---44(X+0.5Y)=44 X=1 Y=6

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.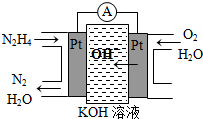 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题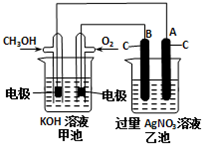 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.