题目内容
(6分)请表示出下列方程式中电子转移的方向和数目,并回答下列问题
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
(1)此反应中,氧化剂是 ,还原剂与氧化剂的物质的量之比是
(2)当生成1.5mol I2时转移的电子数是
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
(1)此反应中,氧化剂是 ,还原剂与氧化剂的物质的量之比是
(2)当生成1.5mol I2时转移的电子数是
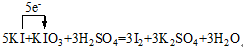
(1) KIO3;5:1 (2)2.5NA或1.505×1024
试题分析:
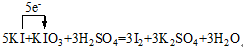
反应中元素化合价变化为:
I:-1→0 失1×5e-
I:+5→0 得5×1e-
氧化剂是KIO3、还原剂是KI,氧化剂与还原剂物质的量比为1:5。每生成3molI2转移电子数为5mol。
点评:氧化还原反应一定要分析清楚元素化合价变化。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题: