题目内容
【题目】H2C2O4为二元弱酸。回答下列问题:
(1)20℃时,配制一组c(H2C2O4)+c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。
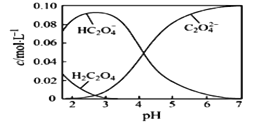
①H2C2O4的电离方程式为___________。
②为获得尽可能纯的NaHC2O4,pH应控制在_______左右。
③NaHC2O4溶液呈酸性,其原因为_________________。
④pH=6时,溶液中含碳微粒浓度大小关系为_______________。
(2)常温下,草酸、碳酸的电离平衡常数如下:
化学式 | H2CO3 | H2C2O4 |
平衡常数 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=5.6×10-2 Ka2=5.4×10-5 |
①常温下,0.1 mol·L-1 Na2CO3溶液的pH____0.1 mol·L-1 Na2C2O4溶液的pH。(填“>”、“<”或“=”)
② pH=4的H2C2O4溶液中c(C2O42-):c(HC2O4-)=_________。
【答案】H2C2O4![]() H+ + HC2O4- 2.5~3之间任一数值均可 HC2O4-的电离程度大于其水解程度 c(C2O42-)>c( HC2O4-)>c(H2C2O4) > 0.54
H+ + HC2O4- 2.5~3之间任一数值均可 HC2O4-的电离程度大于其水解程度 c(C2O42-)>c( HC2O4-)>c(H2C2O4) > 0.54
【解析】
(1)①根据图像H2C2O4溶液中存在的微粒可知H2C2O4多元弱酸,因此分步电离,第一步为主;
②根据图像可以看出pH=2.5~3, HC2O4-的浓度最大;
③利用弱酸的酸式酸根离子的电离平衡和水解平衡进行分析;
④根据图像分析横坐标pH=6时,微粒的浓度大小。
(2)①根据电离常数可知:HC2O4-酸性大于HCO3-,利用越弱越水解原理,可知CO32-的水解能力强于C2O42-;
②根据H2C2O4的第二步电离常数计算;
(1)①多元弱酸分步电离,第一步为主,H2C2O4的电离方程式为H2C2O4![]() H+ + HC2O4-;
H+ + HC2O4-;
答案:H2C2O4![]() H+ + HC2O4-
H+ + HC2O4-
②根据图像可以看出,当pH在2.5~3的范围内, HC2O4-的浓度最大,所以,为获得尽可能纯的NaHC2O4,pH控制在2.5~3之间任一数值均可;
答案:2.5~3之间任一数值均可
③HC2O4-存在两个平衡,电离平衡HC2O4-![]() H+ + C2O42-,水解平衡HC2O4-+H2O
H+ + C2O42-,水解平衡HC2O4-+H2O![]() OH- + H2C2O4,由于HC2O4-电离程度大于水解程度,所以溶液呈酸性;
OH- + H2C2O4,由于HC2O4-电离程度大于水解程度,所以溶液呈酸性;
答案:HC2O4-的电离程度大于其水解程度
④根据图像分析当横坐标pH=6时,纵坐标可以看出溶液中含碳微粒浓度大小关系为c(C2O42-)>c( HC2O4-)>c(H2C2O4);
答案:c(C2O42-)>c( HC2O4-)>c(H2C2O4)
(2)①根据电离常数可知:HC2O4-酸性大于HCO3-,根据越弱越水解原理可知,CO32-的水解能力强于C2O42-,所以常温下,0.1 mol·L-1 Na2CO3溶液的pH大于0.1 mol·L-1 Na2C2O4溶液的pH。
答案:>
②根据H2C2O4的第二步电离常数计算:Ka2=5.4×10-5=![]() =
=![]() ,可得
,可得
pH=4的H2C2O4溶液中c(C2O42-):c(HC2O4-)=0.54;
答案:0.54

 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据见下表:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g.cm3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性________(填“大于”、“等于”或“小于”)相应的醇,其原因是______________________________________________________________。
(3)将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___________________,但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是___________________________。