题目内容
【题目】下列说法正确的是
A. 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀
B. 向0.1 mol·L-1 CH3COONa溶液中加入少量水,溶液中c(H+)/c(CH3COO-)减小
C. 反应TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g);ΔH>0能自发进行,其原因是ΔS>0
D. 一定温度下,增大反应2BaO2(s)![]() 2BaO(s) +O2(g)容器的体积,平衡不移动
2BaO(s) +O2(g)容器的体积,平衡不移动
【答案】C
【解析】
A.Cu与Fe形成原电池时,铜的金属活泼性比铁的弱,铁作负极更易被腐蚀,所以不能在海轮外壳上镶入若干铜块以减缓其腐蚀,故A错误;
B.0.1 mol·L-1 CH3COONa溶液中加入少量水,CH3COO-+H2O![]() CH3COOH+OH-,根据勒夏特列原理,水解平衡虽然正向移动,但是CH3COO-、CH3COOH、OH-浓度均下降。OH-浓度减小,则H+的浓度增大,溶液中c(H+)/c(CH3COO-)增大,故B错误;
CH3COOH+OH-,根据勒夏特列原理,水解平衡虽然正向移动,但是CH3COO-、CH3COOH、OH-浓度均下降。OH-浓度减小,则H+的浓度增大,溶液中c(H+)/c(CH3COO-)增大,故B错误;
C.判断反应是否能自发进行的两个判据:焓判据ΔH>0不符合,则熵判据必须符合ΔS>0,反应才可能自发进行,故C正确;
D. 一定温度下,增大反应2BaO2(s)![]() 2BaO(s) +O2(g)容器的体积,相当于减小压强,平衡向气体体积增大的方向进行,因此平衡正向移动,故D错误;
2BaO(s) +O2(g)容器的体积,相当于减小压强,平衡向气体体积增大的方向进行,因此平衡正向移动,故D错误;
答案:C

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
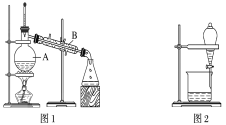
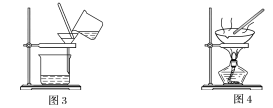
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ||||||
第三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
第四周期 | ⑧ | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:_________(填元素符号)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是:_________,碱性最强的化合物的电子式是:_________。
(3)元素⑤的单质与元素③的最高价氧化物对应的水化物反应的离子方程式为_________。
(4)元素②的简单氢化物是由_________ (填“极性”或“非极性”)键形成的,在常温下该化合物与元素⑥的单质反应的离方程式为__________________。
(5)元素②、③、⑥、⑧四种元素形成的离子,离子半径由大到小的顺序是_________ (用离子符号表示)。
【题目】H2C2O4为二元弱酸。回答下列问题:
(1)20℃时,配制一组c(H2C2O4)+c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。
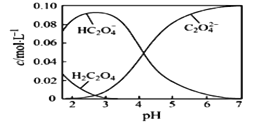
①H2C2O4的电离方程式为___________。
②为获得尽可能纯的NaHC2O4,pH应控制在_______左右。
③NaHC2O4溶液呈酸性,其原因为_________________。
④pH=6时,溶液中含碳微粒浓度大小关系为_______________。
(2)常温下,草酸、碳酸的电离平衡常数如下:
化学式 | H2CO3 | H2C2O4 |
平衡常数 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=5.6×10-2 Ka2=5.4×10-5 |
①常温下,0.1 mol·L-1 Na2CO3溶液的pH____0.1 mol·L-1 Na2C2O4溶液的pH。(填“>”、“<”或“=”)
② pH=4的H2C2O4溶液中c(C2O42-):c(HC2O4-)=_________。