题目内容
【题目】I.氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A 和B。A 为铵盐,B 在标准状况下为气态。在此反应中,若每有1体积氨气参加反应,同时有0.75 体积氟气参加反应;若每有8.96L 氨气(标准状况)参加反应,同时生成0.3 mol A。
(1) 写出氨气和氟气反应的化学方程式___________。
(2) 在标准状况下,每生成2.24LB,转移电子的物质的量为______mol。
Ⅱ.某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现取该固体进行如下实验,所得现象和有关数据如下所示(气体体积的数据均已折算成标准状况下):

请回答下列问题:
(3)混合物中存在的物质有________(填化学式)。
(4)依照反应顺序写出步骤④的离子方程式:_________,___________。
【答案】 4NH3+3F2![]() 3NH4F+NF3 0.6 MgCl2、Al、(NH4)2SO4 H++OH-=H2O AlO2-+H++H2O=Al(OH)3↓
3NH4F+NF3 0.6 MgCl2、Al、(NH4)2SO4 H++OH-=H2O AlO2-+H++H2O=Al(OH)3↓
【解析】I.(1)氨气具有还原性,在铜的催化作用下,氨气和氟气发生反应生成A和B,A为铵盐,A为氟化铵,B在标准状况下为气态,在此反应中,若有1体积氨气参加反应,则有0.75体积氟气参加反应,氨气和氟气的计量数之比是1:0.75=4:3,若有8.96L氨气(标准状况)参加反应,则生成0.3mol A,则氨气和氟化铵的计量数之比=![]() :0.3mol=4:3,反应方程式为:4NH3+3F2
:0.3mol=4:3,反应方程式为:4NH3+3F2 ![]() NF3+3NH4F,故答案为:4NH3+3F2
NF3+3NH4F,故答案为:4NH3+3F2 ![]() NF3+3NH4F;
NF3+3NH4F;
(2)根据方程式4NH3+3F2 ![]() NF3+3NH4F,反应中转移的电子为6e-。在标准状况下2.24L NF3的物质的量为
NF3+3NH4F,反应中转移的电子为6e-。在标准状况下2.24L NF3的物质的量为![]() =0.1mol,则该反应中转移电子的物质的量为0.6mol ,故答案为:0.6;
=0.1mol,则该反应中转移电子的物质的量为0.6mol ,故答案为:0.6;
Ⅱ.(3)由流程图可知:第一步反应的离子方程式为:NH4++OH-═NH3↑+H2O、2Al+2OH-+2H2O═2AlO2-+3H2↑、Mg2++2OH-═Mg(OH)2↓、Al3++4OH-═AlO2-+2H2O,根据生成的气体通过碱石灰体积不变,说明无酸性气体,而通过浓硫酸体积减小,说明剩余的 6.72 L气体为氢气,即原固体中一定含有金属Al,且其质量为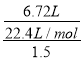 ×27 g/mol=5.4 g;生成氨气的物质的量为
×27 g/mol=5.4 g;生成氨气的物质的量为![]() =0.2 mol,根据氮守恒则原固体中一定含有 0.1 mol (NH4)2SO4,质量为:0.1 mol×132g/mol=13.2g;得到白色沉淀久置不变色,说明无FeCl2,因为氢氧化亚铁易被氧化为红棕色的氢氧化铁;又因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2,其物质的量为0.1 mol,则固体中含有MgCl20.1 mol,质量为9.5g,所以混合物的组成为Al、(NH4)2SO4、MgCl2,故答案为:Al、(NH4)2SO4、MgCl2;
=0.2 mol,根据氮守恒则原固体中一定含有 0.1 mol (NH4)2SO4,质量为:0.1 mol×132g/mol=13.2g;得到白色沉淀久置不变色,说明无FeCl2,因为氢氧化亚铁易被氧化为红棕色的氢氧化铁;又因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2,其物质的量为0.1 mol,则固体中含有MgCl20.1 mol,质量为9.5g,所以混合物的组成为Al、(NH4)2SO4、MgCl2,故答案为:Al、(NH4)2SO4、MgCl2;
(4)反应④中包括盐酸与过量的氢氧化钠反应、偏铝酸根与盐酸反应生成氢氧化铝沉淀,离子方程式为:H++OH-=H2O、AlO2-+H++H2O=Al(OH)3↓;故答案为:H++OH-=H2O、AlO2-+H++H2O=Al(OH)3↓。

【题目】保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:

过程I可用如下反应表示:
①2CO2![]() 2CO+O2
2CO+O2
②2H2O![]() 2H2+O2
2H2+O2
③2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
④2CO2+4H2O![]() 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+H2O![]() +3O2
+3O2
请回答下列问题:
(1)过程I的能量转化形式为: 能转化为 能.
(2)请完成第⑤个反应的化学方程式
(3)上述转化过程中,△H1和△H2的关系是
(4)断裂1mol化学键所需的能量见表:
共价键 | H﹣N | H﹣O | N≡N | O=O |
断裂1mol化学键所需能量/kJmol﹣1 | 393 | 460 | 941 | 499 |
常温下,N2和H2O反应生成NH3的热化学方程式为
