题目内容
3.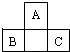 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:AO、BP、CCl.A的原子结构示意图为
 ,B在周期表中的位置第三周期第VA族,C的离子结构示意图为
,B在周期表中的位置第三周期第VA族,C的离子结构示意图为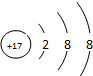 ,A的氢化物分子式为H2O;B、C的最高价氧化物水化物的分子式分别为H3PO4、HClO4,它们的酸性HClO4比H3PO4强.
,A的氢化物分子式为H2O;B、C的最高价氧化物水化物的分子式分别为H3PO4、HClO4,它们的酸性HClO4比H3PO4强.
分析 A、B、C为短周期元素,根据元素在周期表中的位置知,A属于第二周期元素、B和C属于第三周期元素,设A的原子序数是x,则B、C原子序数分别是x+7、x+9,B、C两元素原子序数之和是A元素的原子序数的4倍,即x+7+x+9=4x,x=8,所以A是O元素、B是P元素、C是Cl元素,
O的核外有8个电子,分两层排布;
主族元素原子核外电子层数等于其周期数、最外层电子数等于其主族序数;
C离子为Cl-,氯离子核外有3个电子层、最外层有8个电子;
A的氢化物分子式是H2O;
元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A、B、C为短周期元素,根据元素在周期表中的位置知,A属于第二周期元素、B和C属于第三周期元素,设A的原子序数是x,则B、C原子序数分别是x+7、x+9,B、C两元素原子序数之和是A元素的原子序数的4倍,即x+7+x+9=4x,x=8,所以A是O元素、B是P元素、C是Cl元素,
通过以上分析知,A、B、C分别是O、P、Cl元素;O的核外有8个电子,分两层排布,其原子结构示意图为: ;
;
主族元素原子核外电子层数等于其周期数、最外层电子数等于其主族序数,B原子核外有3个电子层、最外层电子数是5,所以位于第三周期第VA族;
C离子为Cl-,氯离子核外有3个电子层、最外层有8个电子,其结构示意图为 ;A是O元素,A的氢化物分子式是H2O;
;A是O元素,A的氢化物分子式是H2O;
元素的非金属性越强,其最高价氧化物的水化物酸性越强,其氢化物的稳定性越强,非金属性Cl>P,所以其最高价氧化物的水化物酸性HClO4>H3PO4、氢化物的稳定性,故答案为:HClO4>H3PO4;HCl>PH3.
故答案为:O;P;Cl; ;第三周期第VA族;
;第三周期第VA族; ;H2O;H3PO4,HClO4;HClO4,H3PO4.
;H2O;H3PO4,HClO4;HClO4,H3PO4.
点评 本题考查元素周期表和元素周期律的综合应用,明确元素周期表结构、原子结构、元素周期律等知识点即可解答,题目难度不大.

| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH3•H2O ③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② | |
| B. | 常温时,pH=2的CH3COOH溶液和pH=12的氨水等体积混合;pH=2的HCl溶液和pH=12的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定相等 | |
| C. | 常温下0.2mol/L HB溶液和0.1mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.lmol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)>c(OH-) |
| A. | 青铜 | B. | 黄铜 | C. | 硬铝 | D. | 黄金 |
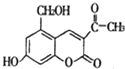 某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图所示.关于“亮菌甲素”的说法中,正确的是( )
某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图所示.关于“亮菌甲素”的说法中,正确的是( )| A. | “亮菌甲素”的分子式为C12H12O5 | |
| B. | “亮菌甲素”可以与乙酸发生酯化反应 | |
| C. | 1 mol“亮菌甲素”最多能和2 mol NaOH反应 | |
| D. | 1 mol“亮菌甲素”最多能和4 mol H2发生加成反应 |
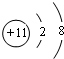
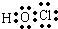
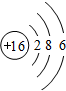
 .
.