题目内容
15.下列热化学方程式中,正确的是( )| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1( ) |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物的反应放出的热量;
B、根据热化学方程式的意义结合反应的量的情况来计算;
C、一定的条件下,中和热是稀的强酸和强碱中和生成1mol水所放出的热量,所以是一个定值;
D、反应是可逆反应,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),不能进行完全,反应的焓变是对应化学方程式物质全部反应时放出的热量.
解答 解:A、甲烷燃烧的热化学方程式中水是气体,不符合燃烧热的概念,故A错误;
B、在101 kPa时,2g即1molH2完全燃烧生成液态水,放出285.8 kJ热量,2molH2完全燃烧生成液态水,放出571.6kJ热量,即2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,故B正确;
C、一定的条件下,中和热是一个定值,H2SO4和Ca(OH)2反应的中和热△H=-57.3kJ•mol-1,故C错误;
D、反应是可逆反应,将0.5 mol N2和1.5 mol H2置于,密闭的容器中充分反应生成NH3(g),不能进行完全,反应的焓变是对应化学方程式物质全部反应时放出的热量,故B错误;
故选B.
点评 本题考查焓变与反应条件的关系、中和热、热化学方程式中焓变与化学计量数的关系,题目难度不大.

练习册系列答案
相关题目
7.某实验需要0.2mol NaOH固体,用托盘天平称取固体时,天平读数(游码及砝码)将( )
| A. | 等于8.0 g | B. | 等于8.00 g | C. | 大于8.0 g | D. | 等于0.2 g |
3. 向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
 向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )| A. | M点对应的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | N点对应的溶液中:K+、NH${\;}_{3}^{+}$、HCO${\;}_{3}^{-}$、Cl- | |
| C. | S点对应的溶液中:Na+、Ag+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | R点对应的溶液中:Na+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$、Cl- |
10.下列叙述错误的是( )
| A. | 已知在常温下醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol•L-1 | |
| B. | 把物质的量浓度相等的盐酸和醋酸溶液分别稀释m倍和n倍,欲使稀释后两溶液的pH相同,则m>n | |
| C. | 常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12 mol•L-1,则该溶液的pH可能是2或12 | |
| D. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,酸碱恰好完全反应时所得溶液的pH=7,因为5<7<8,在石蕊的变色范围内,所以选择石蕊作为指示剂 |
20.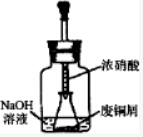 某化学探究小组拟用废铜屑制取Cu(NO3)2并探究其化学性质.
某化学探究小组拟用废铜屑制取Cu(NO3)2并探究其化学性质.
I、如图所示,用浓HNO3和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤依次是:蒸发浓缩、冷却结晶、过滤、洗涤、烘干.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
Ⅱ、为了探究Cu(NO3)2热稳定性,探究小组按下图装置进行实验.(图中铁架台、铁夹和加热仪器均略去)
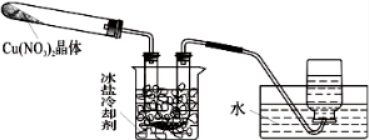
(3)往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;在集气瓶中收集到无色气体.由此判断Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ、利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.下表是化学探究小组的实验记录,据此回答相关问题:
(4)95℃时,制得的样品颜色发暗的可能原因是:含有黑色的氧化铜.
(5)70℃时,实验得到3.82g样品,取此样品加热至分解完全(杂质不反应),得到3.20g固体,此样品中碱式碳酸铜的质量分数是58.1%.
 某化学探究小组拟用废铜屑制取Cu(NO3)2并探究其化学性质.
某化学探究小组拟用废铜屑制取Cu(NO3)2并探究其化学性质.I、如图所示,用浓HNO3和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤依次是:蒸发浓缩、冷却结晶、过滤、洗涤、烘干.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
Ⅱ、为了探究Cu(NO3)2热稳定性,探究小组按下图装置进行实验.(图中铁架台、铁夹和加热仪器均略去)

(3)往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;在集气瓶中收集到无色气体.由此判断Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ、利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.下表是化学探究小组的实验记录,据此回答相关问题:
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
(5)70℃时,实验得到3.82g样品,取此样品加热至分解完全(杂质不反应),得到3.20g固体,此样品中碱式碳酸铜的质量分数是58.1%.
7.下列反应的离子方程式书写正确的是( )
| A. | 氯化铜溶液与锌粉反应:Cu2++Zn═Zn2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe2++6H+═Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与CuSO4 溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
4. 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热△H为-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
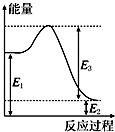
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)值如表:
则△H1=-116kJ•mol-1,在相应的反应条件下,将1mol CO(g)与足量H2(g)充分混合反应只生成CH3OH(g)后,反应焓变>△H1.(用“>”、“<”或“=”填空)
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热△H为-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)值如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能(kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
