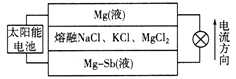
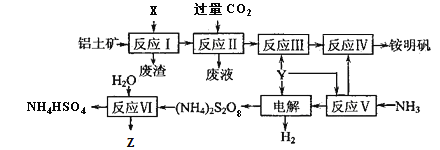
题目内容
【题目】海洋是资源的宝库,海水中所含食盐高达4×1016t。用海水可生产食盐和金属镁或镁的化合物,其过程如下图所示。
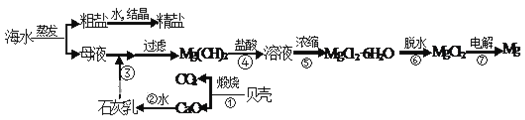
请回答
(1)贝壳主要成分的化学式_________________;
(2)步骤④反应的离子方程式____________________________________________;
(3)实验室由粗盐结晶制精盐的操作包括溶解、过滤、蒸发等步骤,
A.粗盐提纯过程中过滤的目的是____________(填序号)
①获得NaCl晶体 ②除去难溶性物质 ③除去易挥发物质 ④除去可溶性物质
B.过滤需要用到的玻璃仪器有玻璃棒______________、______________。
(4)电解MgCl2制金属Mg的反应方程式为MgCl2![]() Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg_______g,同时可得到氯气__________L(标准状况)。
Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg_______g,同时可得到氯气__________L(标准状况)。
【答案】CaCO3Mg(OH)2+2H+=Mg2++2H2O②漏斗烧杯4.84.48
【解析】
(1)根据贝壳的主要成分是碳酸钙;
(2)根据对应步骤写出对应的离子方程式;
(3)A.粗盐提纯过程中过滤的目的是除去沉淀;B.过滤需要用到的玻璃仪器有玻璃棒、漏斗、烧杯;
(4)根据MgCl2![]() Mg+Cl2↑进行计算。
Mg+Cl2↑进行计算。
(1)根据贝壳的主要成分是碳酸钙,
故答案为:CaCO3;
(2)因反应①是Mg(OH)2与盐酸反应:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(3)A.粗盐提纯过程中过滤的目的是除去沉淀,
故选:②;
B.过滤需要用到的玻璃仪器有玻璃棒、漏斗、烧杯,
故答案为:漏斗;烧杯;
(4)由MgCl2![]() Mg+Cl2↑可知电解0.2molMgCl2生成0.2mol金属Mg、0.2mol氯气,金属Mg的质量为0.2mol×24g/mol=4.8g,氯气的体积为0.2mol×22.4L/mol=4.48L,
Mg+Cl2↑可知电解0.2molMgCl2生成0.2mol金属Mg、0.2mol氯气,金属Mg的质量为0.2mol×24g/mol=4.8g,氯气的体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.8;4.48。