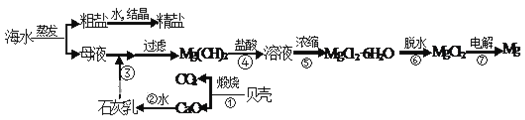
题目内容
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是
A. 体积大小: ④>③>②>① B. 原子数目: ③>①>④>②
C. 密度大小: ④>②>③>① D. 质量大小: ④>③>②>①
【答案】B
【解析】
标准状况下,①6.72 L NH3的物质的量是6.72L÷22.4L/mol=0.3mol;
②1.204×1023个H2S的物质的量是![]() ;
;
③5.6 g CH4的物质的量是5.6g÷16g/mol=0.35mol;
④0.5mol HCl。则
A.相同条件下气体的体积之比是物质的量之比,所以四种物质的体积大小顺序为④>③>①>②,A错误;
B.根据上述分析可知,四种物质中原子的物质的量分别为:1.2mol、0.6mol、1.75mol、1.0mol,因此原子数目大小顺序为:③>①>④>②,B正确;
C.相同条件下,气体的密度之比等于其相对分子质量之比,四种物质的相对分子质量分别为:17、34、16、36.5,因此密度大小顺序为:④>②>①>③,C错误;
D.根据m=n×M可知,四种气体的质量分别为:5.1g、6.8g、5.6g、18.25g,因此四种气体的质量大小顺序为:④>②>③>①,D错误;
答案选B。

 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
下列说法中正确的是
A. 在条件I下,该反应的平衡常数K=10
B. 在条件I下,从开始反应至5min,用H2表示的反应速率为0.10 mol/(L·min)
C. 在条件II下,到达平衡时, I2(g)的转化率为81.25%
D. 与条件I相比,为达到条件II的数据,可能改变的条件是降低压强
【题目】现有含FeCl2杂质的CuCl2·2H2O晶体,为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
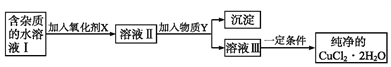
已知:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)得到溶液II,需加入氧化剂X, 加入氧化剂X的目的是____________________________。最适合作氧化剂X的是_________(填编号)。A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入试剂Y,调节溶液的pH范围是__________。下列中不适合作试剂Y的是_______(填编号)。
A.CuO B.Cu(OH)2 C.CuCO3 D.氨水
(3)由溶液Ⅲ得到CuCl2·2H2O晶体的操作是________________________________,过滤,洗涤,干燥。
(4)已知:某难溶物M(OH)3的Ksp=1×10-35 。若要使M3+沉淀完全,溶液的pH最小为______。