题目内容
【题目】(1)对于下列反应:2SO2(g) + O2(g)![]() 2SO3(g) ,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为_________,用O2浓度变化来表示的反应速率为_________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
2SO3(g) ,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为_________,用O2浓度变化来表示的反应速率为_________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________;
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________;

(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将_______(容器不与外界进行热交换,填“升高”或“降低”)。
【答案】 2mol/(L·min) 1mol/(L·min) 2mol/L 升温 减小SO3浓度 降低
【解析】(1)v(SO2)=( 6 mol/L-2 mol/L)÷2min=2mol/(L·min),根据物质的反应速率之比等于物质的化学计量数之比可得 v(O2)= v(SO2)/2=1mol/(L·min);2min内O2浓度的减少量为0.5mol/(L·min)×2min=1mol/L,则SO2浓度的减少量为2×1mol/L=2 mol/L,所以2min时SO2的浓度为4mol/L-2 mol/L=2 mol/L。
(2)a时刻,正逆反应速率都增大,且逆反应速率增大的程度大于正反应速率增大的程度,a~b过程中改变的条件可能是升温;b时刻,正反应速率不变,逆反应速率减小,b~c过程中改变的条件可能是减小SO3浓度。
(3)扩大体积相当于减小压强,上述平衡逆向移动,反应吸热,所以容器内温度降低。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】现有含FeCl2杂质的CuCl2·2H2O晶体,为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
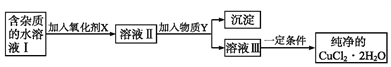
已知:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)得到溶液II,需加入氧化剂X, 加入氧化剂X的目的是____________________________。最适合作氧化剂X的是_________(填编号)。A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入试剂Y,调节溶液的pH范围是__________。下列中不适合作试剂Y的是_______(填编号)。
A.CuO B.Cu(OH)2 C.CuCO3 D.氨水
(3)由溶液Ⅲ得到CuCl2·2H2O晶体的操作是________________________________,过滤,洗涤,干燥。
(4)已知:某难溶物M(OH)3的Ksp=1×10-35 。若要使M3+沉淀完全,溶液的pH最小为______。