题目内容
20.按要求回答下列问题:(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为H2(g)+I2(g)$\frac{\underline{\;\;\;200℃\;\;\;}}{101kPa}$2HI(g)△H=-14.9kJ/mol.
(2)太阳能的开发和利用是21世纪一个重要课题.利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量.已知下列数据:
| 序号 | 盐 | 熔点/℃ | 熔化热/kJ.mol-1 | 参考价格/元.kg-1 |
| ① | CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| ② | Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| ③ | Na2HPO4•12H2O | 36.1 | 100.1 | 1800~2400 |
| ④ | Na2SiO3•5H2O | 52.5 | 49.7 | 1400~1800 |
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值.现已知:
2Na(s)+Cl2(g)═2NaCl(s)△H=-821.8kJ.mol-1
2Cl(g═Cl(g)△H=-239.4kJ.mol-1
Na(s)═Na(g)△H=+108.8kJ.mol-1
Na(g)═Na+(g)+e-△H=+496.0kJ.mol-1
Cl(g)+e-═Cl-(g)△H=-348.7kJ.mol-1
则NaCl的晶格能为786.7kJ/mol.
分析 (1)根据热化学方程式的概念书写热化学方程式;
(2)根据表中信息判断哪种物质的熔点在40℃以下,并且单位质量的物质熔化时吸收的热量多等方面进行分析、考虑,从而得出正确的结论;
(3)氯化钠的晶格能为反应Na+(g)+Cl-(g)=NaCl(s)中释放的能量,设该反应的焓变为△H,根据盖斯定律及已知热化学方程式进行计算即可.
解答 解:(1)在200℃、101kPa时,H2与碘蒸气作用生成2molHI气体,放出14.9kJ的热量.热化学方程式可表示为:H2(g)+I2(g)$\frac{\underline{\;\;\;200℃\;\;\;}}{101kPa}$2HI(g)△H=-14.9kJ/mol,
故答案为:H2(g)+I2(g)$\frac{\underline{\;\;\;200℃\;\;\;}}{101kPa}$2HI(g)△H=-14.9kJ/mol;
(2)选择的物质应该具有的特点是:在白天在太阳照射下,某种盐熔化,熔化时单位质量的物质吸收热量应该最多,同时价格不能太高,Na2SO4•10H2O的性价比最高,
故答案为:②;
(3)氯化钠的晶格能为反应Na+(g)+Cl-(g)=NaCl(s)中释放的能量,设该反应的焓变为△H,
①2Na(s)+Cl2(g)═2NaCl(s)△H=-821.8kJ.mol-1
②2Cl(g)═Cl2(g)△H=-239.4kJ.mol-1
③Na(s)═Na(g)△H=+108.8kJ.mol-1
④Na(g)═Na+(g)+e-△H=+496.0kJ.mol-1
⑤Cl(g)+e-═Cl-(g)△H=-348.7kJ.mol-1
根据盖斯定律,①×$\frac{1}{2}$+②×$\frac{1}{2}$-③-④-⑤可得:Na+(g)+Cl-(g)=NaCl(s)△H=$\frac{1}{2}$(-821.8kJ.mol-1)+$\frac{1}{2}$(-239.4kJ.mol-1)-(+108.8kJ.mol-1)-(+496.0kJ.mol-1)-(-348.7kJ.mol-1)=-786.7kJ/mol,
则氯化钠的晶格能为786.7kJ/mol,
故答案为:786.7kJ/mol.
点评 本题考查了热化学方程式的计算、盖斯定律在反应热中的计算,题目难度中等,明确热化学方程式的书写原则为解答关键,注意掌握盖斯定律的含义及在反应热计算中的应用方法.

 阅读快车系列答案
阅读快车系列答案①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎
④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2.
| A. | ①②③⑥ | B. | ①②④⑥ | C. | ①②③④ | D. | ①②③④⑤ |
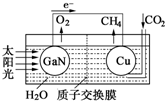
| A. | 该装置为原电池,且铜为正极 | |
| B. | 电池工作时,H+向Cu电极移动 | |
| C. | GaN电极表面的电极反应式为:2H2O-4e-═O2+4H+ | |
| D. | 反应CO2+2H2O═CH4+2O2中每消耗1mol CO2转移4mol e- |