题目内容
【题目】钙及其化合物在生产、生活中的应用比较广泛。
回答下列问题:
(1)草酸钙(CaC2O4)常用于陶瓷上釉。将草酸钙溶于强酸可得草酸(H2C2O4),再加入KMnO4溶液发生氧化还原反应。此反应的氧化产物为_____________(填化学式)。
(2)碳酸钙可用于煤燃烧时的脱硫。
已知:反应I :CaCO3(s)=CaO(s)+CO2(g) △H1= +178.3 kJ mol-1;
反应II:CaO(s)+SO2(g)=CaSO3(s) △H2= -402.0 kJ mol-1;
反应III:2CaSO3(s)+O2(g)=2CaSO4(s) △H3= -2314.8 kJ mol-1 △H3= -2314.8 kJ mol-1。
① 反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)的△H=______kJ mol-1。

② 向某恒温密闭容器中加入CaCO3,发生反应I,反应达到平衡后,t1时,缩小容器体积,x随时间(t)的变化关系如图1所示,x可能是____________(任写两个)。
(3)将Ca(OH)2加入Na2WO4碱性溶液中,发生反应IV:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)
CaWO4(s)+2OH-(aq)
① 反应IV在较高温度下才能自发进行,则△S_____0(填“>”“=”或“<”,下同),△H_______0。
② T1时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=1×10-8,反应Ⅳ:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)的平衡常数K=______;请在图2中画出T1下Ca(OH)2和CaWO4的沉淀溶解平衡曲线。
CaWO4(s)+2OH-(aq)的平衡常数K=______;请在图2中画出T1下Ca(OH)2和CaWO4的沉淀溶解平衡曲线。
③制取CaWO4时,为了提高WO42-的转化率,常需要适时向反应混合液中添加少量的某种稀酸,该稀酸可能为_______(填选项字母)。
A.稀盐酸 B.稀硝酸 C.稀硫酸 D.碳酸
【答案】 ![]()
![]()
![]() ;
;![]() 或气体的密度 > > 100;
或气体的密度 > > 100;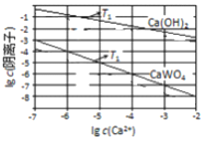 AB
AB
【解析】(1)H2C2O4具有还原性作还原剂,把KMnO4还原为MnSO4,自身被氧化为二氧化碳,其反应的方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,反应中的氧化产物为二氧化碳,故答案为:CO2;
(2)①反应I :CaCO3(s)=CaO(s)+CO2(g) △H1= +178.3 kJ mol-1;反应II:CaO(s)+SO2(g)=CaSO3(s) △H2= -402.0 kJ mol-1;反应III:2CaSO3(s)+O2(g)=2CaSO4(s) △H3= -2314.8 kJ mol-1。根据盖斯定律,将Ⅰ×2+Ⅱ×2+Ⅲ得:2CaCO3(s)+2SO2(g)+O2(g)= 2CaSO4(s)+2CO2(g)△H=( +178.3 kJ mol-1)×2+(-402.0 kJ mol-1)×2+(-2314.8 kJ mol-1)=-2762.2 kJ mol-1,故答案为:-2762.2;
② 根据反应CaCO3(s)=CaO(s)+CO2(g) △H1= +178.3 kJ mol-1;反应达到平衡后,t1时,缩小容器体积,x突然增大,但重新平衡后x与原平衡相同,说明温度不变,平衡常数不变,则x可能是逆反应速率或二氧化碳的浓度或气体的密度等,故答案为:v(逆);c(CO2)或气体的密度;
(3)① 根据△G=△H-T△S,反应IV:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)的△S>0,要在较高温度下才能自发进行,需要△G<0,则△H>0,故答案为:>;>;
CaWO4(s)+2OH-(aq)的△S>0,要在较高温度下才能自发进行,需要△G<0,则△H>0,故答案为:>;>;
② T1时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=1×10-8,反应Ⅳ:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)的平衡常数K=
CaWO4(s)+2OH-(aq)的平衡常数K=![]() =
=![]() =
=![]() =
=![]() =100,T1下当c(Ca2+)=10-2mol/L时,c(OH-)=10-3mol/L,c(WO42-)=10-4mol/L,即lg c(Ca2+)=-2时,lg c(OH-)=-3 ,lg c(WO42-)=-8,同理,lg c(Ca2+)=-6时,lg c(OH-)=-1 ,lg c(WO42-)=-4,Ca(OH)2和CaWO4的沉淀溶解平衡曲线为
=100,T1下当c(Ca2+)=10-2mol/L时,c(OH-)=10-3mol/L,c(WO42-)=10-4mol/L,即lg c(Ca2+)=-2时,lg c(OH-)=-3 ,lg c(WO42-)=-8,同理,lg c(Ca2+)=-6时,lg c(OH-)=-1 ,lg c(WO42-)=-4,Ca(OH)2和CaWO4的沉淀溶解平衡曲线为 ,故答案为:100;
,故答案为:100; ;
;
③A.稀盐酸,与氢氧根离子应,平衡正向移动,可以提高WO42-的转化率,正确;B.稀硝酸与氢氧根离子反应,平衡正向移动,可以提高WO42-的转化率,正确;C.稀硫酸与氢氧化钙反应生成微溶于水的硫酸钙沉淀,不能提高WO42-的转化率,错误;D.碳酸与氢氧化钙反应生成难溶于水的碳酸钙沉淀,不能提高WO42-的转化率,错误;故选AB。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
