题目内容
【题目】【化学—选修3:物质结构与性质】
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是_______,基态Cr原子的价电子排布式是_____。
(2)用“>”或“<”填空:
第一电离能 | 键能 | 沸点 | 离子半径 |
Be_____B | C—C_____Si—Si | H2S_____H2O | Al3+_____O2- |
(3)BeCl2分子的空间构型是______,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是_____。
![]()
(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式______。
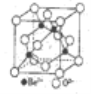
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞连长为___cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示)。
【答案】(1)3p 3d54s1
(2)> > < <
(3)直线型 sp3
(4)SiH4+2O2=SiO2+2H2O
(5)![]()
【解析】
试题分析:(1)基态铝原子的电子排布为1s22s22p63s23p1,最高能级为3p。基态铬的价电子排布为3d54s1(2)铍原子的电子排布为1s22s2,铍硼的电子排布为1s22s22p1,铍是全满结构,第一电离能大于铍。碳原子半径比硅原子半径小,键长短,键能大。水分子间有氢键,所以水的沸点比硫化氢的高。铝离子与氧离子都有10个电子,核电荷数越大,半径越小。所以铝离子半径小于氧离子半径。(3)氯化铍中铍是sp1杂化,两个键夹角为180度,为直线型;二聚题中铍的杂化轨道类型由单体的sp杂化变为sp3杂化,铍原子提供轨道,氯原子有孤对电子对,。(4)四氢氧化硅在空气中与氧气反应生成二氧化硅和水方程式为:SiH4+2O2=SiO2+2H2O。(5)![]() 。
。
分子 | BeCl2 | BF3 | SiCl4 |
价电子对数 | 2 | 3 | 4 |
几何构型 | 直线型 | 平面三角形 | 正四面体 |
中心原子杂化类型 | sp | sp2 | sp3 |

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案