题目内容
某Mg-Al合金放入足量HCl溶液中,生成H2的体积在标准状况下是2 240 mL;同质量该Mg-Al合金放入足量NaOH溶液中,生成H2的体积在标准状况下是2 016 mL,则合金中Mg、Al的质量之比是( )
| A.1:1 | B.6:1 | C.1:6 | D.4:27 |
D
因为Mg、Al均能与盐酸反应放出H2,而只有Al能与NaOH溶液反应放出H2,因此,先根据Al与NaOH(aq)的反应,求出Al的质量:
2Al+2NaOH+2H2O══2NaAlO2+3H2↑
54 g 67.2L
m(Al) 2.016L
m(Al)=1.62g。
再根据Mg与HCl(aq)的反应求出Mg的质量:
Mg+2HCl══MgCl2+H2↑
24 g 22.4L
m(Mg) 2.240 L-2.016 L
m(Mg)="0.24" g。
最后求合金中Mg、Al质量比:
m(Mg)∶m(Al)="1.62" g∶0.24 g=27∶4。
2Al+2NaOH+2H2O══2NaAlO2+3H2↑
54 g 67.2L
m(Al) 2.016L
m(Al)=1.62g。
再根据Mg与HCl(aq)的反应求出Mg的质量:
Mg+2HCl══MgCl2+H2↑
24 g 22.4L
m(Mg) 2.240 L-2.016 L
m(Mg)="0.24" g。
最后求合金中Mg、Al质量比:
m(Mg)∶m(Al)="1.62" g∶0.24 g=27∶4。

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
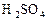 反应,生成
反应,生成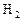 2.8L(标准状况),原混合物的质量可能是( )
2.8L(标准状况),原混合物的质量可能是( )