题目内容
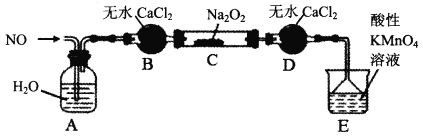
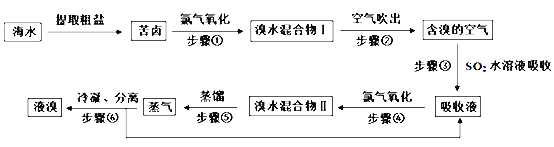
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是

已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.
A.过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤后加盐酸
B.过程②通过氧化还原反应可产生1种单质
C.在过程③中将MgCl26H2O直接灼烧得到MgCl2
D.在过程④、⑥反应中每氧化0.2molBr-需消耗标准状况下2.24LCl2
【答案】D
【解析】
如图所示为海水综合利用的流程工艺图,途中包含了海水的三种工业利用方式,一是海水提取精盐及氯碱工业,二是海水制镁,三是海水提溴。
A. 在粗盐提纯过程中,应当先加钡离子后加碳酸根离子,故A错误;
B. 氯碱工业是电解饱和食盐水,生成物有氢气和氯气两种单质,故B错误;
C. MgCl26H2O直接受热生成Mg(OH)Cl和HCl气体等,应该在氯化氢氛围中加热,故C错误;
D. Br-的氧化产物为溴单质,每2molBr-被氧化生成1molBr2会失去2mol电子,每1molCl2被还原生成2molCl-得到2mol电子,每氧化0.2molBr-需消耗标准状况下2.24LCl2,故D正确;
故答案选D。

【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。
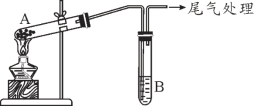
(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。