题目内容
【题目】有可逆反应Fe(s)+CO2(g)![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)1mol铁粉和1molCO2在2L密闭容器中反应,判断该反应达到平衡状态的依据是 (填序号)。
A.容器内压强不再改变
B.c(CO)不再改变
C.生成1mol的FeO
D.c(CO2)=c(CO)
E.v正(CO2)=v逆(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.4 mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K= (保留二位有效数字)。
(4)一定条件下,该反应在体积固定的密闭容器中进行一段时间后达到平衡状态。使该平衡状态正向移动的措施有(写出两条) 、 。
【答案】(1)BE(2)吸热(3)0.71
(4)升高反应温度;增大CO2浓度;减小CO浓度
【解析】
试题分析:(1)A.混合气体物质的量不变,恒温恒容下,容器内压强为定值,故A错误;B.c(CO)保持不变,说明正逆反应速率相等,反应到达平衡,所以B选项是正确的;D.平衡时CO2、CO浓度与二氧化碳的转化率有关,不一定相等,故D错误,E.v正(CO2)=v逆(CO)时,CO的消耗速率与生成速率相等,反应达到了平衡状态,所以C选项是正确的;所以BE选项是正确的;
(2)温度升高平衡常数增大,说明升高温度平衡正向移动,正反应为吸热反应,因此,本题正确答案是:吸热;
(3)Fe(s)+CO2(g)![]() FeO(s) + CO(g)化学平衡常数表达式
FeO(s) + CO(g)化学平衡常数表达式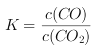 ,CO2的起始浓度为2.0 mol/L,某温度时达到平衡,此时容器中CO的浓度1.0 mol/L,则平衡时CO2的浓度为1.0 mol/L,则该温度下平衡常数K=1.0/1.0=1.0,因此,本题正确答案是1.0;
,CO2的起始浓度为2.0 mol/L,某温度时达到平衡,此时容器中CO的浓度1.0 mol/L,则平衡时CO2的浓度为1.0 mol/L,则该温度下平衡常数K=1.0/1.0=1.0,因此,本题正确答案是1.0;
(4)①正反应为吸热反应,升高温度平衡正向移动,二氧化碳物质的量减小,混合气体总物质的量不变,二氧化碳的物质的量分数减小;②再通入CO,平衡常数不变,则混合气体中CO与二氧化碳的物质的量之比不变,则CO2的物质的量分数不变,因此,本题正确答案是:减小;不变.

【题目】向A、B、C和D四支试管中的溶液分别进行表中的操作,通过观察到的实验现象得出的结论正确的是( )
操作 | 现象 | 结论 | |
A | ①滴加稀HNO3②滴加BaCl2溶液 | 无明显现象白色沉淀 | 原溶液一定含 |
B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含 |
C | ①滴加稀HCl②滴加AgNO3溶液 | 无明显现象白色沉淀 | 原溶液一定含Cl- |
D | ①滴加KCSN溶液②滴加氯水 | 无明显现象溶液呈红色 | 原溶液一定含Fe2+ |
A. A B. B C. C D. D