题目内容
T ℃、2 L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体)。回答下列问题。
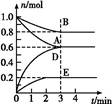
(1)写出该反应的化学方程式: 。
(2)反应开始至3 min时,用D表示的平均反应速率为 mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K= 。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 。
(5)另有一个2 L的密闭容器,T ℃、某一时刻,容器中各物质的物质的量如表所示。
此时v(正) v(逆)(填“大于”、“等于”或“小于”)。

(1)写出该反应的化学方程式: 。
(2)反应开始至3 min时,用D表示的平均反应速率为 mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K= 。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 。
(5)另有一个2 L的密闭容器,T ℃、某一时刻,容器中各物质的物质的量如表所示。
| 物质 | A | B | D | E |
| 物质的量(mol) | 0.8 | 1.0 | 0.4 | 0.2 |
此时v(正) v(逆)(填“大于”、“等于”或“小于”)。
(1)2A(g)+B(g) 3D(g)+E(s)
3D(g)+E(s)
(2)0.1 (3)0.75 (4)30% (5)大于
 3D(g)+E(s)
3D(g)+E(s)(2)0.1 (3)0.75 (4)30% (5)大于
(1)3 min时,A、B、D、E的物质的量变化量分别为0.4 mol、0.2 mol、0.6 mol、0.2 mol,故其化学计量数之比为2∶1∶3∶1,因此反应的化学方程式为2A(g)+B(g) 3D(g)+E(s)。
3D(g)+E(s)。
(2)v(D)=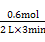 ="0.1" mol·L-1·min-1。
="0.1" mol·L-1·min-1。
(3)3 min时,A、B、D的物质的量分别为0.6 mol、0.8 mol、0.6 mol,则K=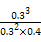 =0.75。
=0.75。
(4)因反应前后气体体积不变,所以缩小体积(增大压强)平衡不移动,D的体积分数与3 min时相等,为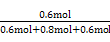 ×100%=30%。
×100%=30%。
(5)可计算出Q=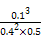 =0.0125<0.75,故平衡正向移动,v(正)大于v(逆)。
=0.0125<0.75,故平衡正向移动,v(正)大于v(逆)。
 3D(g)+E(s)。
3D(g)+E(s)。(2)v(D)=
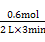 ="0.1" mol·L-1·min-1。
="0.1" mol·L-1·min-1。(3)3 min时,A、B、D的物质的量分别为0.6 mol、0.8 mol、0.6 mol,则K=
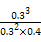 =0.75。
=0.75。(4)因反应前后气体体积不变,所以缩小体积(增大压强)平衡不移动,D的体积分数与3 min时相等,为
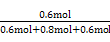 ×100%=30%。
×100%=30%。(5)可计算出Q=
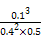 =0.0125<0.75,故平衡正向移动,v(正)大于v(逆)。
=0.0125<0.75,故平衡正向移动,v(正)大于v(逆)。
练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
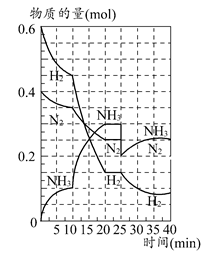
 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。 C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是( )
C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是( ) 反应中,表示该反应速率最快的是( )。
反应中,表示该反应速率最快的是( )。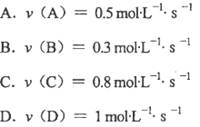
 2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是( )
2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是( ) 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) [mol/(L·min)]表示,则正确的关系式是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) [mol/(L·min)]表示,则正确的关系式是( ) v(NH3)=v(O2)
v(NH3)=v(O2) v(O2)=v(H2O)
v(O2)=v(H2O) v(NH3)=v(H2O)
v(NH3)=v(H2O) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
 2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( )
2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( ) 4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )