题目内容
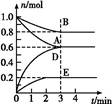
500℃时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,分析图像完成下列问题:
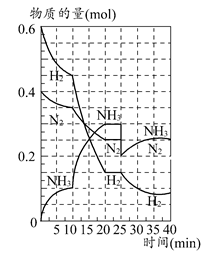
(1)0~10分钟,N2的平均反应速率为________mol·L-1·min-1,0~10分钟与10~20分钟两个时间段中,N2的反应速率之比为________。反应在第10 min可能改变的条件是________,运用图像信息说明该条件不是升温的原因:________。
(2)计算500℃时,反应N2+3H2 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
(3)在上图中画出25~40 min时间段内N2的物质的量的变化图像。

(1)0~10分钟,N2的平均反应速率为________mol·L-1·min-1,0~10分钟与10~20分钟两个时间段中,N2的反应速率之比为________。反应在第10 min可能改变的条件是________,运用图像信息说明该条件不是升温的原因:________。
(2)计算500℃时,反应N2+3H2
 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。(3)在上图中画出25~40 min时间段内N2的物质的量的变化图像。
(1)0.0025;1:2;加入催化剂;三种气体物质的速率增加倍数相同 (2)426.7;不变;小 (3)如图所示。
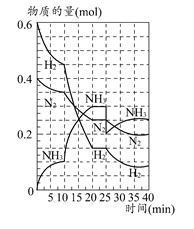

(1)由图像和速率的计算公式可求知0~10 min,v(N2)=0.05 mol/(2 L×10 min)=0.0025 mol·L-1·min-1;10~20 min,v(N2)=0.1 mol/(2 L×10 min)=0.005 mol·L-1·min-1,所以0~10 min与10~20 min的v(N2)之比为1:2;根据计算10~20 min的v(N2),v(H2),v(NH3)知,三者均增大为原来的2倍,故在10 min时应该是加入了催化剂,而不是升温。(2)500°C时,根据平衡常数K的计算公式即可求得平衡常数K的数值,K=c2(NH3)/c(N2)c3(H2)=0.152/(0.125×0.0753)≈426.7,K只受温度影响,所以减少NH3的量K值不变,但NH3减少后,由于体积不变,浓度减小,故反应速率减小。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
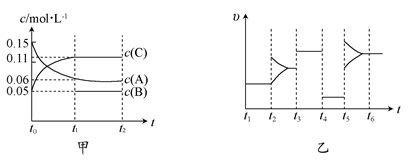
 xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )

 Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):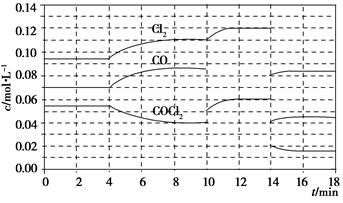
 2C(g)
2C(g)