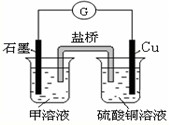
题目内容
A、B、C、D、E是周期表中短周期元素,它们的原子序数依次增大,A和D的最外层电子数是其电子层数的2倍,B和D同主族,C的原子是短周期元素中原子半径最大的。请回答:
(1)写出元素名称:A 、B 。
(2)已知AD2与AB2的结构相似,AD2的结构式为 ,
该分子是 (填“极性”或“非极性”)分子。
(3)常温下将E单质通入到C的最高价氧化物对应的水化物溶液里发生反应的离子方程
式为 。
(4)请写出B和C按原子个数比1∶1形成的化合物与A和B按按原子个数比1∶2形成的化合物反应的化学方程式,并标出电子转移的方向和数目 。
②(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
| Z | |||||||||||||||||
| M | L | Q | R | ||||||||||||||
| D | A | T | X | Y | |||||||||||||
| E | J | ||||||||||||||||
(1)Y分别与D、E形成的化合物中熔点较高是_________(用具体物质的化学式表示)。
(2)LY4分子的电子式是_____ ____。高#考¥ 资@源 网
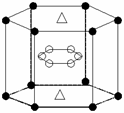 (3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。J(LR)4固态时属于_________晶体(填晶体类型)。
(3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。J(LR)4固态时属于_________晶体(填晶体类型)。
(4)A与M组成的一种化合物AM2,刷新了金属化合物超导温度
的最高记录。右图中所示的是该化合物的晶体结构单元。图中
上、下底面中心“Δ”处的原子是_______(填元素符号)。
①(14分)(1)碳 氧(各2分) (2)![]() (2分) 非极性 (2分)
(2分) 非极性 (2分)
(3)![]() (3分)
(3分)
(4)略(3分)
②(8分,每空2分)(1)NaCl (2)略 (3)分子 (4) Mg

 名校课堂系列答案
名校课堂系列答案| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热