题目内容
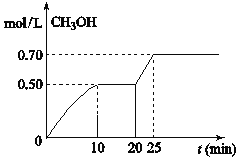
【题目】将4g氢氧化钠和mg碳酸钠混合并配成溶液,向溶液中滴加一定浓度的稀盐酸,加入盐酸的体积和生成二氧化碳的质量的关系如图所示,回答下列问题:(不考虑二氧化碳的溶解)
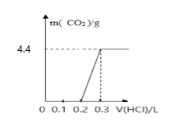
(1)加入盐酸的体积为0.2L时,溶液中溶质的成分为___;
(2)碳酸钠的质量m=___;
(3)盐酸的物质的量浓度为___。
【答案】NaHCO3、NaCl 10.6g 1mol/L
【解析】
向氢氧化钠和碳酸钠的混合溶液中滴加一定浓度的稀盐酸,发生反应的顺序及化学方程式为:①NaOH+HCl=NaCl+H2O ②Na2CO3+HCl=NaHCO3+NaCl ③NaHCO3+ HCl= NaCl +H2O+CO2↑,由反应②③可以看出,盐酸和碳酸钠溶液反应分两步进行,并且这两步消耗的盐酸是等量的。图中混合液完全反应消耗的盐酸为0.3L,加入盐酸体积0~0.1发生反应①,0.1~0.2发生反应②,0.2~0.3发生反应③,再结合图中给出的相关量可以计算碳酸钠的质量和盐酸的物质的量浓度。
(1)加入盐酸的体积为0.2L时,发生的反应是NaOH+HCl=NaCl+H2O和Na2CO3+HCl=NaHCO3+NaCl,此时溶液中的溶质为NaHCO3和NaCl 。
答案为:NaHCO3、NaCl;
(2)图中盐酸体积0.1~0.3时,是盐酸和碳酸钠反应生成二氧化碳的过程,根据关系式:Na2CO3 ~ CO2可以算出,生成4.4g CO2时,对应Na2CO3的质量为10.6g。
答案为:10.6g;
(3)图中盐酸体积0~0.1L时,发生反应为:NaOH+HCl=NaCl+H2O,氢氧化钠质量是4g,物质的量是0.1mol,则盐酸的物质的量也为0.1mol,由公式C=n/V,可以求出盐酸的物质的量浓度为1mol/L。
答案为:1mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
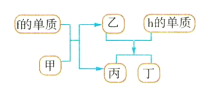
请写出h的单质与乙反应的化学方程式:___。