题目内容
14.硫、碳、氮等元素及其化合物与人类的生产生活密切相关,其中.硫酸、氨气、硝酸都是重要的化工原料.而SO2、NO、NO2、CO等相应氧化物又是主要的环境污染物:(1)过度排放CO2会造成“温室效应”,而煤的气化是高效、清洁利用煤炭的重要途径.煤综合利用的一种途径如图1所示.
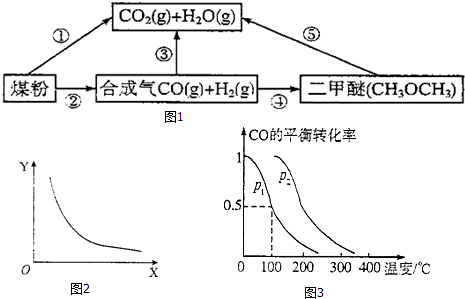
已知:C(s)+H2O(g)=CO(g)+H2(g) AH1=+131.3kJ•mol-
C(s)十2H20(g)=C02(g)+2H2(g) AH2=+90kJ•mol-
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ•mol-1.
(2)298K时.将氨气放入体积固定的密闭容器中使其发生分解反应.当反应达到平衡状态后.改变其中一个条件X.Y随X的变化符合图2中曲线的是ab(填字号):
a.当X表示温度时,Y表示氨气的物质的量
b.当X表示压强时.Y表示氨气的转化率
c.当X表示反应时间时.Y表示混合气体的密度
d.当x表示氨气的物质的量时.Y表示某一生成物的物质的量
(3)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染.必须经脱除达标后才能排放:
能作脱除剂的物质很多.下列说法正确的是abd(填序号):
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
d.用尿素[CO(NH2)2]作脱除剂.在一定条件下能有效将NOx氧化为N2
(4)在压强为O.1MPa条件下,容积为V L的密闭容器中,amol CO与2amol H2在催化剂作用下
反应生成甲醇.反应的化学方程式为CO(g)+2H2(g)?CH3OH(g),CO的平衡转比率与温度、
压强的关系如图3所示,则:
①P1<P2(填“>”“<”或“=”).
②在其他条件不变的情况下,向容器中增加a molCO与2amol H2.达到新平衡时.CO的转化率
增大(填“增大””减小”或“不变”.下同),平衡常数不变.
③在P1下、100℃时,CH3OH(g)?CO(g)十2H2(g)的平衡常数为$\frac{a{\;}^{2}}{V{\;}^{2}}$(用含a、V的代数式
表示).
(5)①常温下.若将2mol NH3(g)和l mol CO2(g)通入1L水中.可得pH=10的溶液,则该溶液中浓度最大的阴离子是CO32-;
②常温下,将O.01mol•L- NaOH溶液和0.01mol•L-(NH4)2SO4溶液等体积混合.所得溶液pH为10,那么该混合液中c(Na+)+c(NH4+)=10-2+10-4-10-10mol•L-1(填准确代数式.不能估算).
分析 (1)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ•mol-1 ②
由盖斯定律②-①得CO(g)+H2O(g)=CO2(g)+H2(g),以此计算△H;
(2)a.随温度升高,平衡向吸热即正反应方向移动,氨气的物质的量逐渐减小;
b.随压强增大,平衡向气体体积减小即逆反应反应移动,氨气的转化率逐渐减小;
c.随反应进行,密闭体积中混合气体的密度自始至终不变;
d.随氨气的物质的量增加,某一生成物的物质的量逐渐增加;
(3)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO;
b.亚硫酸钠不稳定,易被氧气氧化;
c.用CO作脱除剂,则氮氧化物得电子发生还原反应;
d.尿素[CO(NH2)2]中N元素化合价为-3价,具有还原性,在一定条件下能有效将NOx转化为氮气;
(4)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;
②温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动;平衡常数只受温度影响,温度不变,平衡常数不变;
③该温度下,平衡时n(CO)=amol×(1-0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol-2×amol×0.5=amol,则c(CO)=$\frac{0.5a}{V}$mol/L、c(CH3OH)=$\frac{0.5a}{V}$mol/L、c(H2)=$\frac{a}{V}$mol/L,化学平衡常数K=$\frac{c(CO)×c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{3}OH)}$计算;
(5)①将2mol NH3(g)和l mol CO2(g)通入1L水中,恰好生成碳酸铵,据此分析即可;
②依据电中性原则列出式子,代入数据计算即可.
解答 解:(1)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ•mol-1 ②
由盖斯定律②-①得:
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ•mol-1
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ•mol-1;
(2)a.当X表示温度时,平衡向吸热即正反应方向移动,氨气的物质的量逐渐减小,故a正确;
b.当X表示压强时,平衡向气体体积减小即逆反应反应移动,氨气的转化率逐渐减小,故b正确;
c.当X表示反应时间时,密闭体积中混合气体的密度自始至终不变,故c错误;
d.当x表示氨气的物质的量时,某一生成物的物质的量逐渐增加,故d错误;
故答案为:ab;
(3)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO,不利于吸收含氮烟气中的NO,故a正确;
b.亚硫酸钠不稳定,易被氧气氧化,O2会降低Na2SO3的利用率,故b正确;
c.用CO作脱除剂,被氧化,则氮氧化物得电子发生还原反应,不会生成NO2,烟气中NO2的浓度不增加,故c错误;
d.尿素[CO(NH2)2]中N元素化合价为-3价,具有还原性,在一定条件下能有效将NOx转化为N2.故d正确.
故答案为:abd;
(4)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,故答案为:<;
②温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大.平衡常数只受温度影响,温度不变,平衡常数不变.
故答案为:增大;不变;
③该温度下,平衡时n(CO)=amol×(1-0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol-2×amol×0.5=amol,则c(CO)=$\frac{0.5a}{V}$mol/L、c(CH3OH)=$\frac{0.5a}{V}$mol/L、c(H2)=$\frac{a}{V}$mol/L,化学平衡常数K=$\frac{c(CO)×c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{3}OH)}$=$\frac{\frac{0.5a}{V}×(\frac{a}{V}){\;}^{2}}{\frac{0.5a}{V}}$=$\frac{a{\;}^{2}}{V{\;}^{2}}$,故答案为:$\frac{a{\;}^{2}}{V{\;}^{2}}$;
(5)①将2mol NH3(g)和l mol CO2(g)通入1L水中,恰好生成碳酸铵,化学反应方程式为:2NH3+CO2+H2O=(NH4)2CO3,故溶液中存在浓度最大的阴离子是碳酸根,故答案为:CO32-;
②设两种溶液体积均为V,混合后,该溶液中的阳离子是:Na+、NH4+和H+,阴离子是:OH-和SO42-,依据电中性原则有:c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),故c(Na+)+c(NH4+)=2c(SO42-)+c(OH-)-c(H+)=2×$\frac{0.01mol/L×1L}{1L+1L}$+$\frac{10{\;}^{-14}}{10{\;}^{-10}}$-10-10=0.01+10-4-10-10=10-2+10-4-10-10,故答案为:10-2+10-4-10-10.
点评 本题主要考查的是反应的焓变判断,热化学方程式的书写,化学平衡的影响因素,氧化还原法除有毒气体,可逆反应转化率随温度和压强变化的曲线,要求学生具备依据图象所给的信息获取分析问题的能力,还涉及平衡常数的计算、溶液中离子浓度大小比较以及电中性原则的应用,有一定难度.

| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 明矾常作为净水剂,双氧水通常可用于杀菌消毒 | |
| C. | 金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是硅 |
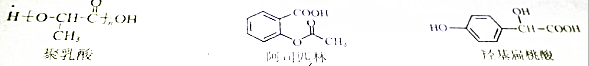
| A. | 三种有机物都能发生酯化反应 | |
| B. | 聚乳酸分子中存在酯基、羧基、羟基 | |
| C. | 羟基扁桃酸在浓硫酸作用下能生成含三个六元环结构的有机物 | |
| D. | 等物质的量的阿司匹林与羟基扁桃酸能消耗的NaOH的量相等 |
| 元素 | 相关信息 |
| X | 元索周期表中核电荷数最小的元素 |
| Y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量最多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是3d104s1.
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线形.
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)═4ZO2(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)═2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
| A. | 苯甲酸钠 | B. | 瘦肉精 | C. | 三聚氰胺 | D. | 甲醇 |

 ,写出其合成路程图.
,写出其合成路程图.