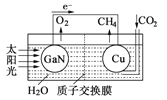
题目内容
【题目】在恒温恒容的密闭容器中,有可逆反应:![]() 。下列不能说明反应已达到平衡状态的是( )
。下列不能说明反应已达到平衡状态的是( )
A.![]()
B.反应器中的压强不随时间的变化而变化
C.混合气体的颜色保持不变
D.混合气体的平均相对分子质量保持不变
【答案】A
【解析】
A.![]() 时,反应达到平衡状态,而v(NO2)=v(O2)未体现正与逆的关系,不能判定反应是否达平衡,故A符合题意;
时,反应达到平衡状态,而v(NO2)=v(O2)未体现正与逆的关系,不能判定反应是否达平衡,故A符合题意;
B.反应前后气体的化学计量数之和不相等,随着反应的进行体系压强逐渐减小,当达到平衡时,气体的压强不变,达平衡状态,故B不符合题意;
C.混合气体的颜色不再改变,说明![]() 气体的浓度不变,达到平衡状态,C不符合题意;
气体的浓度不变,达到平衡状态,C不符合题意;
D.反应前后气体的化学计量数之和不相等,当达到平衡时,气体的物质的量不变,则混合气体的平均摩尔质量不再改变,故D不符合题意;
故答案:A。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目