��Ŀ����
12������������SnSO4����һ����Ҫ�������Σ���Ҫ���ڵ�ƹ�ҵ�Ķ��������Ͻ�����������ɫ��ӡȾ��ҵ��ýȾ����˫��ˮȥ�����ȣ�ij�о�С�����SnSO4�Ʊ�·�����£�
�������ϣ�
�����������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ�������
��SnCl2��ˮ������������Sn��OH��Cl����ʽ�Ȼ���������
III��Sn��OH��2��������Al��OH��3�������ƣ���ش��������⣺
��1��SnCl2��ĩ���Ũ��������ܽ⣬����������ԭ���Ǽ������ᣬʹˮ��ƽ�������ƶ�������Sn2+ˮ�⣮
��2����Ӧ��õ�������SnO���õ��ó��������ӷ���ʽ��Sn2++CO32-�TSnO��+CO2����
��3������ӦI��Һ�е�������ȡ�����IJ����������ᾧ����ҺI���ʵijɷ���NaCl��Na2CO3��
��4�����������£�SnSO4����������˫��ˮȥ������������Ӧ�����ӷ���ʽ��Sn2++H2O2+2H+=Sn4++2H2O��
��5����ȡSnSO4•x H2O����50.2g���ڸ��������������С��������ᾧˮȫ��ʧȥ����ȴ������������Ϊ43g����ʽ����þ���Ļ�ѧʽΪSnSO4•2H2O��
���� SnCl2��ĩ��Ũ��������ܽ�õ�������Һ����ʱ��Һ�к���Sn2+��Sn4+�������м���Sn�ۣ�Sn�ۿ��Ժ�H+������Ӧ��ʹ��Һ���Լ�������������ҺpHֵ������Sn���Խ����������ɵ�Sn4+��ԭ��Sn2+������ֹSn2+������ΪSn4+�����˵�SnCl2��Һ�������м�̼���ƣ���SnԪ����SnO��ʽ����������ϴ�ӵô�����SnO����ӦI��Һ������Ϊ�Ȼ��ƺ�̼���ƣ�SnO�м�ϡ���ᣬ��SnSO4��Һ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ��Ƶ�SnSO4���壻
��1��SnCl2��ˮ�з���ˮ�ⷴӦ������HCl����ʹˮ��ƽ�����淴Ӧ�����ƶ�������Sn2+ˮ�⣻
��2����Ӧ��Ϊ��SnCl2��Һ�м�̼���ƣ��õ��ij���ΪSnO�����ݵ���غ��Ԫ���غ���д���ӷ���ʽ��
��3����ӦI��Һ������Ϊ�Ȼ��ƺ�̼���ƣ�����ͨ�������ᾧ�ķ���������ʣ�
��4�����������£�SnSO4����������˫��ˮȥ��������SnSO4�����������º�˫��ˮ��Ӧ��Sn2+�л�ԭ�ԣ�˫��ˮ�������ԣ�����Ӧ���ǣ�Sn4+��H2O��
��5�����ݷ�ӦSnSO4•x H2O$\frac{\underline{\;\;��\;\;}}{\;}$SnSO4+x H2O���ɾ��弰���ɹ���������б���ʽ�����x��ֵ��
��� �⣺SnCl2��ĩ��Ũ��������ܽ�õ�������Һ����ʱ��Һ�к���Sn2+��Sn4+�������м���Sn�ۣ�Sn�ۿ��Ժ�H+������Ӧ��ʹ��Һ���Լ�������������ҺpHֵ������Sn���Խ����������ɵ�Sn4+��ԭ��Sn2+������ֹSn2+������ΪSn4+�����˵�SnCl2��Һ�������м�̼���ƣ���SnԪ����SnO��ʽ����������ϴ�ӵô�����SnO����ӦI��Һ������Ϊ�Ȼ��ƺ�̼���ƣ�SnO�м�ϡ���ᣬ��SnSO4��Һ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ��Ƶ�SnSO4���壬
��1��SnCl2��ˮ�з���ˮ�ⷴӦ��SnCl2+H2O�TSn��OH��Cl+HCl�����淴Ӧ��Ӧ���ÿ���ţ�������������Sn��OH��Cl����Һ�������ʣ�������HCl����ʹƽ�����淴Ӧ�����ƶ�������Sn2+ˮ�⣻
�ʴ�Ϊ���������ᣬʹˮ��ƽ�������ƶ�������Sn2+ˮ�⣻
��2����Ӧ��Ϊ��SnCl2��Һ�м�̼���ƣ��õ��ij���ΪSnO����Ӧ���ӷ���ʽΪSn2++CO32-�TSnO��+CO2����
�ʴ�Ϊ��Sn2++CO32-�TSnO��+CO2����
��3����ӦI��Һ������Ϊ�Ȼ��ƺ�̼���ƣ�����ͨ�������ᾧ�ķ����������ΪNaCl��Na2CO3��
�ʴ�Ϊ�������ᾧ��NaCl��Na2CO3��
��4�����������£�SnSO4����������˫��ˮȥ��������SnSO4�����������º�˫��ˮ��Ӧ��Sn2+�л�ԭ�ԣ�˫��ˮ�������ԣ�����Ӧ���ǣ�Sn4+��H2O������ʽΪSn2++H2O2+2H+=Sn4++2H2O��
�ʴ�Ϊ��Sn2++H2O2+2H+=Sn4++2H2O��
��5�����ݷ�ӦSnSO4•x H2O$\frac{\underline{\;\;��\;\;}}{\;}$SnSO4+x H2O��
215+18x 215
50.2g 43g
$\frac{215+18x}{50.2g}=\frac{215}{43g}$��x=2�����Ըþ���Ļ�ѧʽΪSnSO4•2H2O��
�ʴ�Ϊ��SnSO4•2H2O��
���� ���⿼�������ʷ���ķ�����ʵ�������ˮ�����Ӧ�ã��ζ�ʵ��ļ����жϺͼ���Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | �����[Zn��NH3��4]Cl2��λ��Ϊ6 | |
| B�� | �����[Zn��NH3��4]Cl2�У�����ΪNH3��Cl-��[Zn��NH3��4]2+Ϊ�ڽ� | |
| C�� | �����[Zn��NH3��4]Cl2��Zn2+��NH3�����Ӽ���� | |
| D�� | ��NH4+��Fe��CO��5�ж�������λ�� |
| A�� | ʵ������MnO2��Ũ������ȡCl2��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2Cl-+Cl2��+2H2O | |
| B�� | ��NaHSO4��Һ�еμ�Ba��OH��2��Һ�����ԣ�SO42-+2H++Ba2++2OH-�TBaSO4��+2H2O | |
| C�� | ʯ������Na2CO3��Һ��ϣ�Ca2++CO32-�TCaCO3�� | |
| D�� | NH4ClŨ��Һ�еμ�ŨNaOH��Һ�����ȣ�NH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O |
| A�� | NO�� NO2 | B�� | 168O��188O | C�� | O2��O3 | D�� | CH4��C2H6 |
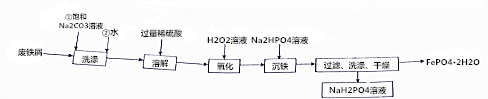
 ��Na2HPO4�ĵ��뷽��ʽΪNa2HPO4=2Na++HPO42-��
��Na2HPO4�ĵ��뷽��ʽΪNa2HPO4=2Na++HPO42-��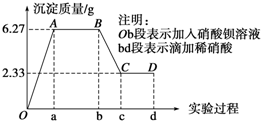 ������ij��ѧ�о���ѧϰС���ij��ɫˮ���ɷֵļ�����̣���֪��ˮ����ֻ���ܺ���K+��Mg2+��Fe3+��Cu2+��Ag+��Ca2+��CO${\;}_{3}^{2-}$��SO${\;}_{4}^{2-}$��Cl-�е����������ӣ���С��ͬѧȡ100mLˮ������ʵ�飺����Ʒ���ȵμ����ᱵ��Һ���ٵμ�1mol•L-1���ᣬʵ������г��������ı仯��ͼ��ʾ��
������ij��ѧ�о���ѧϰС���ij��ɫˮ���ɷֵļ�����̣���֪��ˮ����ֻ���ܺ���K+��Mg2+��Fe3+��Cu2+��Ag+��Ca2+��CO${\;}_{3}^{2-}$��SO${\;}_{4}^{2-}$��Cl-�е����������ӣ���С��ͬѧȡ100mLˮ������ʵ�飺����Ʒ���ȵμ����ᱵ��Һ���ٵμ�1mol•L-1���ᣬʵ������г��������ı仯��ͼ��ʾ��