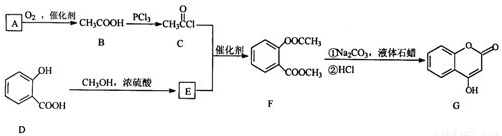
题目内容
实验室常用下列三个反应制备Cl2:①MnO2与浓盐酸反应制备氯气;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O; ③KClO3+6HCl(浓)=KCl+3Cl2+3H2O如果分别用上述方法制得等量的Cl2,下列说法中正确的是
- A.参加反应的HCl的物质的量相等
- B.转移电子的总数相等
- C.消耗氧化剂的物质的量相等
- D.被氧化的氯离子数不相等
D
A错,MnO2与浓盐酸反应制备氯气方程式为: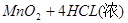 ====(△)
====(△)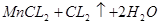 ;每生成1mol氯气参加反应的HCL的物质的量为4mol;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O;每生成1mol氯气参加反应的HCL的物质的量为3.2mol;③KClO3+6HCl(浓)=KCl+3Cl2+3H2O;每生成1mol氯气参加反应的HCL的物质的量为2mol;
;每生成1mol氯气参加反应的HCL的物质的量为4mol;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O;每生成1mol氯气参加反应的HCL的物质的量为3.2mol;③KClO3+6HCl(浓)=KCl+3Cl2+3H2O;每生成1mol氯气参加反应的HCL的物质的量为2mol;
B错,反应①中每生成1mol氯气转移的电子总数为2mol;反应②中每生成1mol氯气转移的电子总数为2mol;反应③中中每生成1mol氯气转移的电子总数为 mol;C错,反应①中每生成1mol氯气消耗氧化剂MnO2的物质的量为1mol;反应②中每生成1mol氯气消耗氧化剂KMnO4的物质的量为0.4mol;反应③中中每生成1mol氯气消耗氧化剂KClO3的物质的量为
mol;C错,反应①中每生成1mol氯气消耗氧化剂MnO2的物质的量为1mol;反应②中每生成1mol氯气消耗氧化剂KMnO4的物质的量为0.4mol;反应③中中每生成1mol氯气消耗氧化剂KClO3的物质的量为 ;D正确;
;D正确;
A错,MnO2与浓盐酸反应制备氯气方程式为:
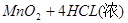 ====(△)
====(△)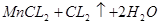 ;每生成1mol氯气参加反应的HCL的物质的量为4mol;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O;每生成1mol氯气参加反应的HCL的物质的量为3.2mol;③KClO3+6HCl(浓)=KCl+3Cl2+3H2O;每生成1mol氯气参加反应的HCL的物质的量为2mol;
;每生成1mol氯气参加反应的HCL的物质的量为4mol;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O;每生成1mol氯气参加反应的HCL的物质的量为3.2mol;③KClO3+6HCl(浓)=KCl+3Cl2+3H2O;每生成1mol氯气参加反应的HCL的物质的量为2mol;B错,反应①中每生成1mol氯气转移的电子总数为2mol;反应②中每生成1mol氯气转移的电子总数为2mol;反应③中中每生成1mol氯气转移的电子总数为
 mol;C错,反应①中每生成1mol氯气消耗氧化剂MnO2的物质的量为1mol;反应②中每生成1mol氯气消耗氧化剂KMnO4的物质的量为0.4mol;反应③中中每生成1mol氯气消耗氧化剂KClO3的物质的量为
mol;C错,反应①中每生成1mol氯气消耗氧化剂MnO2的物质的量为1mol;反应②中每生成1mol氯气消耗氧化剂KMnO4的物质的量为0.4mol;反应③中中每生成1mol氯气消耗氧化剂KClO3的物质的量为 ;D正确;
;D正确; 
练习册系列答案
相关题目
 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:
 2NH3,
2NH3,