题目内容
 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:(1)X、Y、Z第一电离能由小到大的顺序为
(2)E元素基态原子的电子排布式为
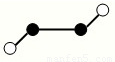
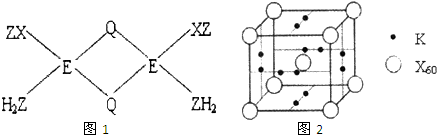
(3)X和Z形成有毒气体XZ,实验室常用EQ溶液吸收并定量测定XZ的含量.反应时,XZ与EQ形成配合物的分子中原子问成键关系如图1所示:E+和Q之间的化学键类型是
(4)XZ2分子中含有
(5)Z氢化物的沸点比Q氢化物的沸点高,理由是
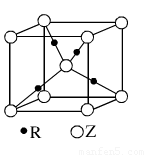
(6)X元素可形成X60.单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为
(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以X、Y、Z第一电离能由小到大的顺序为C<O<N,
故答案为:C;O;N;
(2)E是29号元素铜,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为:ls22s22p63s23p63d104s1,故答案为:ls22s22p63s23p63d104s1;
(3)含有孤电子对的原子和含有空轨道的原子之间易形成配位键,铜原子中含有孤电子对,Cl元素中含有空轨道,所以二者能形成配位键,故答案为:配位键;
(4)O=C=O分子中含有两个双键,双键中一个是π键,所以二氧化碳分子中含有2个π键,故答案为:2;
(5)Z的氢化物是水,Q的氢化物是氯化氢,氢键的存在导致氢化物的沸点升高,所以水的沸点大于氯化氢,故答案为:H2O分子间能形成氢键,HCl分子间不能形成氢键;
(6)该晶胞中C60个数=1+8×
| 1 |
| 8 |
| 1 |
| 2 |

(16分) 已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
|
元素 |
结构或性质信息 |
|
X |
原子的L层上s电子数等于p电子数。 |
|
Y |
原子核外的L层有3个未成对电子。 |
|
Z |
在元素周期表的各元素中电负性仅小于氟。 |
|
Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
|
R |
核电荷数是Y与Q的核电荷数之和 |
|
E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2) X、Y、Z三种元素的第一电离能由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式) 。
(4)R的核外电子排布式为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心原子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6) Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为 。
 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】